Entschärfte Viren als Impfstoffe nutzen
Wie entschärfte Viren besonders effektiv als Impfstoff eingesetzt werden können
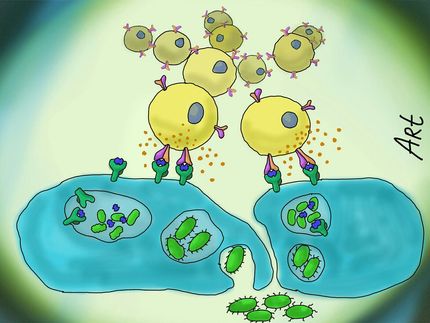
Viren sind lästige und häufig gefährliche Krankheitserreger, viele von ihnen bleiben aber gut versteckt und verursachen nur milde bis gar keine Krankheiten. Diese Viren können in veränderter Form als Hilfsmittel zum Schutz vor anderen Erregern dienen. Ihre infektiösen Eigenschaften machen sich Forscher zunutze, indem sie die krankmachenden Bestandteile ausschalten, die entschärften Viren mit Bruchstücken anderer, gefährlicher Krankheitserreger beladen und dieses Konstrukt mittels Impfung in den Körper einbringen. So lernt der Körper die Moleküle der gefährlichen Erreger kennen – die Abwehrzellen bilden ein immunologisches Gedächtnis. An sich harmlose Viren können somit den Immunschutz gegen tödliche Infektionserreger vermitteln. Kommt der Körper nochmals mit dem Erreger in Kontakt, erkennt das Immunsystem die Moleküle schnell wieder und neutralisiert den Erreger, bevor er eine Krankheit auslöst.
WerbeFabrik, pixabay.com, CC0
Wissenschaftler des Helmholtz-Zentrums für Infektionsforschung (HZI) in Braunschweig haben nun herausgefunden, dass für die Stärke der Immunantwort entscheidend ist, an welcher Stelle die Bruchstücke in den Trägervirus eingebracht werden und welches die optimale Position dafür ist. Diese Erkenntnisse sind entscheidend, um den Einsatz von Viren als Impfstoff weitgehend zu optimieren und Impfstoffe mit geringem Gefahrenpotenzial zu entwickeln.
Herpes-Viren bilden eine große Familie aus mittlerweile über 200 bekannten Mitgliedern. Neun davon befallen gezielt den Menschen und verbleiben nach der Erstinfektion meist ein Leben lang im Körper. Eines dieser Viren ist das Cytomegalievirus (CMV), das mindestens 40 Prozent aller Erwachsenen in Deutschland in sich tragen. Meist bleibt es inaktiv, kann aber zum Beispiel durch eine Immunschwäche aktiviert werden und Schäden an verschiedenen Organen verursachen. Das Virus löst eine sehr starke Reaktion des Immunsystems aus, bei der eine große Anzahl bestimmter Immunzellen – sogenannte T-Zellen – gegen das Virus gebildet wird.
Dabei merken sich die Immunzellen bestimmte Bausteine der Viren, die sie bei einer erneuten Infektion erkennen und somit gleich die passende Abwehrreaktion einleiten können. Diese Eigenschaften können Forscher nutzen, um CMV für Impfungen einzusetzen: In das Erbmaterial künstlich abgeschwächter Cytomegalieviren bauen sie Genfragmente anderer Viren ein und schleusen sie in den Körper. Dort veranlasst CMV, dass das eingebaute Genfragment in Proteine übersetzt wird, die der Körper als fremd erkennt und T-Zellen gegen sie bildet. Dabei dienen immer nur kurze Abschnitte als Erkennungssequenz, und nicht alle führen zu einer starken Bildung von Abwehrzellen.
„Was dazu führt, dass manche Sequenzen eines Proteins eine starke Immunantwort auslösen, andere aber nicht, war bislang nicht genau bekannt“, sagt Prof. Luka Cicin-Sain, der am HZI die Arbeitsgruppe „Immunalterung und chronische Infektionen“ leitet. Um das Rätsel zu lösen, hat das Team um Cicin-Sain eine Erkennungssequenz des Herpes simplex-Virus, das unter anderem den Lippenherpes auslöst, an verschiedenen Stellen eines Cytomegalievirus eingebaut und damit Mäuse infiziert. Anschließend haben die Wissenschaftler anhand der gebildeten Immunzellen die Stärke der Immunantwort bestimmt. „Wir konnten feststellen, dass die Reaktion des Immunsystems auf eine Erkennungssequenz davon abhängt, wo genau im CMV diese Sequenz eingebaut ist“, sagt Cicin-Sain. In weiteren Untersuchungen konnten die Wissenschaftler auch einen Grund dafür aufdecken: War die Sequenz an einer bestimmten Position im CMV eingebaut, wurde das von ihr abgeleitete Protein in besonders vielen Zellen des Körpers weiterverarbeitet und für die Bildung spezifischer Abwehrzellen genutzt.
Dahinter steht eine Art Recycling-Maschinerie der Zellen, die Proteine in kleine Fragmente zerschneidet und diese für den Aufbau neuer Proteine zur Verfügung stellt. Der Körper – ob Mensch oder Maus – besitzt zwei Ausführungen dieser Maschinerie, eine universelle in allen Zellen und eine spezielle, die nur in Immunzellen vorkommt. Dringen Krankheitserreger in den Körper ein, zerschneidet die Recycling-Maschinerie auch ihre Proteine in kleine Fragmente, die dann als Erkennungssequenz für Abwehrzellen dienen können und von diesen als Erinnerungsmerkmal verwendet werden. „Wir konnten in unseren Experimenten zeigen, dass je nach Position im CMV die eingebaute Sequenz entweder nur von der Recycling-Maschinerie der Immunzellen oder von beiden Maschinerien erkannt wurde“, sagt Cicin-Sain. „Im zweiten Fall entstehen einfach viel mehr Proteinfragmente, wodurch das Immunsystem auch viel mehr spezifische T-Zellen bilden kann.“
Ob die so verstärkte Abwehrreaktion des Immunsystems auch die Wirkung einer Impfung verbessern würde, haben die Wissenschaftler am Beispiel des Gebärmutterhalskrebses getestet: Dieser Tumor wird ausgelöst durch Humane Papillomviren, gegen die bereits eine Impfung etabliert ist. Bestimmte Genabschnitte der Humanen Papillomviren haben die HZI-Forscher an verschiedene Stellen von CMV eingebaut und Mäuse mit diesen Konstrukten geimpft. Einige Monate nach der Impfung haben sie die Mäuse mit Zellen des Gebärmutterhalskrebses infiziert. Dabei bestätigten sich die vorherigen Ergebnisse: Waren die Mäuse mit dem CMV-Konstrukt geimpft, das die meisten Abwehrzellen entstehen ließ, konnte ihr Immunsystem alle Tumorzellen beseitigen – die Mäuse blieben gesund. „Die Ergebnisse zeigen, dass CMV als Transporter bei Impfungen gut geeignet ist und wir wissen nun auch, wie wir die beste Wirksamkeit erzielen können“, sagt Luka Cicin-Sain. „In der klinischen Anwendung ist diese Methode in Europa allerdings noch nicht zugelassen, da weitere Studien zur Absicherung notwendig sind.“