Ein Virus als Symbiose-Partner
Das Mavirus verleiht Einzellern Immunität gegen ein Riesenvirus
Viren sind allgegenwärtig und befallen nahezu alle Organismen auf der Erde. Um solche Parasiten unter Kontrolle zu halten, haben Lebewesen verschiedene Abwehrstrategien entwickelt. Forscher am Max-Planck-Institut für medizinische Forschung in Heidelberg haben jetzt in einem Einzeller einen neuartigen Abwehrmechanismus gegen Viren entdeckt. Dabei verleiht ein Virus seinem Wirt mit einem Trick Immunität gegen ein anderes Virus.
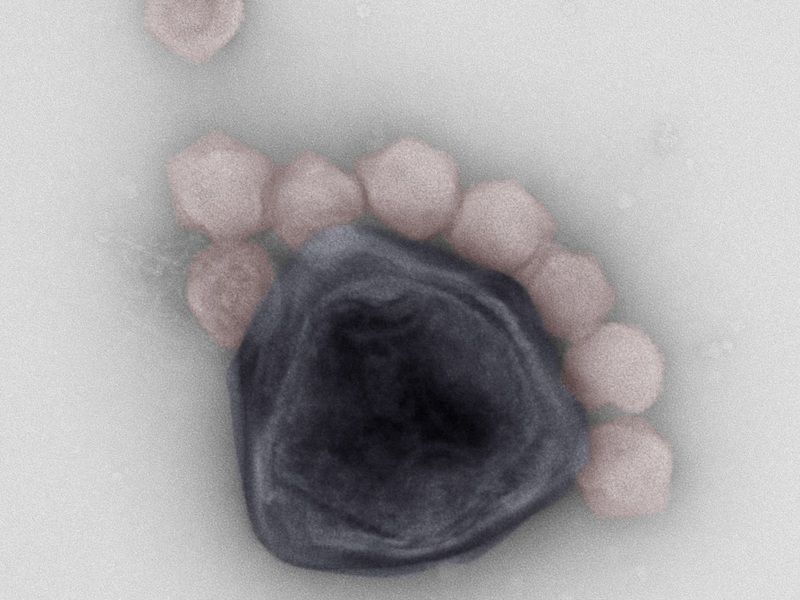
Partikel des Riesenvirus CroV (blau) und des Virophagen Mavirus (rot).
© MPI f. medizinische Forschung/ U. Mersdorf und M. Fischer
Der Flagellat Cafeteria roenbergensis kommt in allen Weltmeeren vor. Er ernährt sich größtenteils von Bakterien und spielt deshalb eine entscheidende Rolle im Nahrungsnetz der Ozeane. Der Einzeller kann von einem Riesenvirus mit dem Namen CroV infiziert und getötet werden. Riesenviren enthalten die Erbinformation für hunderte Proteine, mit deren Hilfe sie neue Viruspartikel in sogenannten „Virenfabriken“ im Innern ihrer Wirtszelle bilden.Die Vielfalt an Enzymen in diesen „Fabriken“ zieht kleinere Viren an, sogenannte Virophagen, die das Riesenvirus im Innern der gemeinsamen Wirtszelle parasitieren. Das sogenannte Mavirus ist ein solcher Virophage. Es infiziert Cafeteria roenbergensis und blockiert dann die Vermehrung der Riesenviren. Aus einer mit beiden Viren befallenen Zelle werden deshalb ausschließlich Mavirus-, aber keine neuen CroV-Partikel freigesetzt. Im Sinne von „Der Parasit meines Parasiten ist mein Freund“ kann eine Population von C. roenbergensis Zellen also in der Gegenwart von Maviren eine Infektion mit CroV überleben.
Matthias Fischer und Thomas Hackl vom Max-Planck-Institut für medizinische Forschung haben diese Form des Hyperparasitismus im Dreiersystem von Virus-Virophage-Wirt nun noch genauer untersucht und entdeckt, dass das Mavirus sein Erbgut in das der Wirtszelle einschleusen kann. Dort sind seine Gene zunächst inaktiv, es werden also keine Proteine produziert. Erst wenn CroV dieselbe Zelle infiziert, werden die Mavirus-Gene aktiv und erzeugen Virophagen. Die Wirtszelle produziert daneben auch Riesenviren, bis sie platzt und zugrunde geht.
Schutz nur bei gleichzeitiger Infektion
Die entstandenen Maviren können nun aber die Vermehrung von CroV verhindern, wenn sie zeitgleich mit diesen eine neue Wirtszelle infizieren. Dadurch entstehen keine neuen CroV-Partikel mehr, und der noch gesunde Teil einer Cafeteria roenbergensis-Population ist vor einer Infektion durch die Riesenviren geschützt. „Warum dagegen die Vermehrung von CroV in den zuerst infizierten Zellen nicht blockiert wird, ist noch nicht ganz klar. Wahrscheinlich reagieren die im Erbgut integrierten und stillgelegten Maviren langsamer auf die Infektion mit einem Riesenvirus, als wenn beide Viren gleichzeitig eine Zelle befallen“, erklärt Fischer vom Heidelberger Max-Planck-Institut. Offenbar muss das Mavirus bereits in der Zellflüssigkeit der Wirtszelle vorhanden sein, wenn CroV sich vermehrt. Die Reaktivierung des integrierten Mavirus erfolgt anscheinend so spät, dass das Riesenvirus seine neuen Partikel bereits gebildet hat, bevor das Mavirus eingreifen kann.
Diese Form der Immunität schützt allerdings nur auf Populationsebene gegen die Riesenviren. Jede Wirtszelle, die von CroV befallen wird, ist dem Untergang geweiht – auch wenn sie zeitgleich mit Maviren infiziert wird. Durch die Freisetzung reaktivierter Mavirus-Partikel während der Lyse unterbindet die sterbende Zelle aber die Produktion weiterer Riesenviren und sichert so das Überleben der noch nicht mit CroV infizierten Zellen. „Die Wirtszelle opfert sich also gewissermaßen für die Allgemeinheit und schützt die übrige Population vor dem Tod durch die Riesenviren“, sagt Fischer.
Mavirus geht auch ohne Riesenviren nicht verloren
Als Virophage benötigt das Mavirus für seine Vermehrung eine Wirtszelle, die gleichzeitig mit einem Riesenvirus infiziert ist. In einer Wirtszellenpopulation ohne Riesenviren könnte es folglich nicht fortbestehen. Durch den Einbau in das Wirtsgenom wird das Mavirus aber von der Zelle im passiven Zustand erhalten und kann so über lange Zeit weiter existieren, bis der im Ruhezustand verharrende Virophage durch eine Begegnung mit CroV aktiviert wird.
Nicht alle Viren sind also Parasiten, zwischen Cafeteria roenbergensis und den Maviren besteht vielmehr eine Symbiose. Die ökologische Funktion dieses neu entdeckten Verteidigungsmechanismus ist noch nicht geklärt. „Wir haben unsere Studie unter kontrollierten Laborbedingungen durchgeführt. Die Bedeutung der auf Virophagen basierten Immunität in der Natur können wir deshalb noch nicht beurteilen“, erläutert Fischer. „Weil wir aber jetzt wissen, wonach wir suchen müssen, können wir das Erbgut anderer Einzeller auf Anzeichen integrierter Virophagen durchforsten und herausfinden, wie weit dieses Verteidigungssystem verbreitet ist.“
Originalveröffentlichung
Matthias G. Fischer & Thomas Hackl; "Host genome integration and giant virus-induced reactivation of the virophage mavirus"; Nature; 540, 288-291 (2016)