Motten und Magnete könnten Leben retten
Experimentelle Therapie könnte Mutationen reparieren, die genetische Krankheiten verursachen
Eine neue Technologie, die auf einem motteninfizierenden Virus und Nanomagneten basiert, könnte verwendet werden, um defekte Gene zu bearbeiten, die zu Krankheiten wie Sichelzellenanämie, Muskeldystrophie und Mukoviszidose führen.
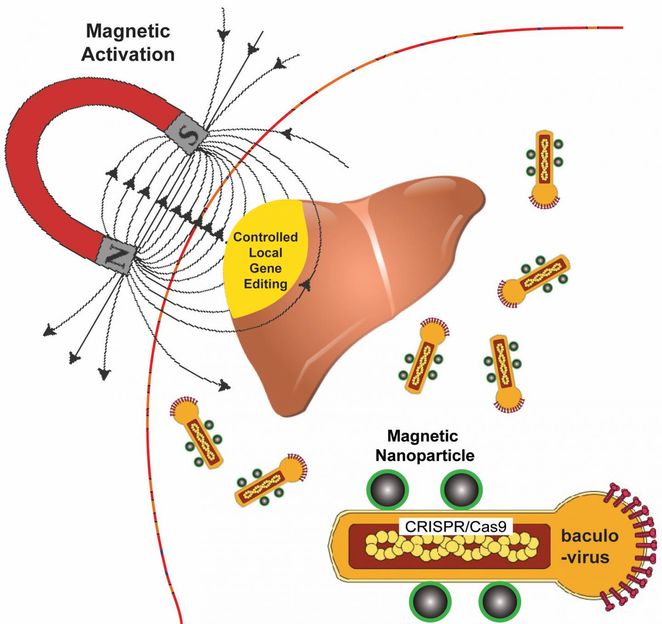
Die Bioingenieure der Rice University nutzen ein Magnetfeld, um an Nanopartikel gebundene Baculoviren in einem Gewebe zu aktivieren. Die Viren, die normalerweise Alfalfa-Looper-Motten infizieren, werden so modifiziert, dass sie geneditierenden DNA-Code nur an Zellen liefern, die mit magnetfeld-induzierter lokaler Transduktion angesteuert werden.
Laboratory of Biomolecular Engineering and Nanomedicine/Rice University
Der Bioingenieur der Rice University, Gang Bao, hat magnetische Nanopartikel mit einem viralen Behälter aus einer bestimmten Mottenart kombiniert, um CRISPR/Cas9-Nutzlasten zu liefern, die Gene in einem bestimmten Gewebe oder Organ mit räumlicher Kontrolle modifizieren.
Da Magnetfelder einfach zu manipulieren sind und im Gegensatz zu Licht leicht durch das Gewebe gehen, wollen Bao und seine Kollegen damit die Expression viraler Nutzlasten in Zielgewebe kontrollieren, indem sie das ansonsten im Blut inaktivierte Virus aktivieren.
In der Natur stärkt CRISPR/Cas9 das Immunsystem von Mikroben, indem es die DNA von Eindringlingen erfasst. Das gibt Mikroben die Möglichkeit, zurückkehrende Eindringlinge zu erkennen und anzugreifen, aber Wissenschaftler haben sich bemüht, CRISPR/Cas9 anzupassen, um Mutationen zu reparieren, die genetische Krankheiten verursachen, und die DNA in Laborexperimenten zu manipulieren.
CRISPR/Cas9 hat das Potenzial, Erbkrankheiten zu stoppen - wenn es den Wissenschaftlern gelingt, die Genombearbeitungsmaschine zu den richtigen Zellen im Körper zu bringen. Aber es gibt nach wie vor Hindernisse, insbesondere bei der Bereitstellung der Nutzlasten für die Genbearbeitung mit hoher Effizienz.
Bao sagte, es wird notwendig sein, Zellen im Körper zu bearbeiten, um viele Krankheiten zu behandeln. "Aber die effiziente Bereitstellung von Genombearbeitungsmaschinen in das Zielgewebe im Körper mit räumlicher Kontrolle bleibt eine große Herausforderung", sagte Bao. "Selbst wenn Sie den Virusvektor lokal injizieren, kann er in andere Gewebe und Organe gelangen, und das könnte gefährlich sein."
Das von der Bao-Gruppe entwickelte Lieferfahrzeug basiert auf einem Virus, das die Autographa californica, auch bekannt als Alfalfa-Looper, eine in Nordamerika heimische Motte, infiziert. Der zylindrische Baculovirus-Vektor (BV), der nutzentragende Teil des Virus, gilt mit bis zu 60 Nanometern Durchmesser und 200-300 Nanometern Länge als groß. Das ist groß genug, um mehr als 38.000 Basenpaare DNA zu transportieren, was ausreicht, um mehrere Gen-Editing-Einheiten an eine Zielzelle zu liefern, sagte Bao.
Er sagte, dass die Inspiration zur Kombination von BV und magnetischen Nanopartikeln von Gesprächen mit dem Postdoc-Forscher und Co-Leiter Haibao Zhu kam, der während einer Postdoc-Zeit in Singapur von dem Virus erfuhr, aber nichts über magnetische Nanopartikel wusste, bis er dem Bao-Labor beitrat. Das Rice Team hatte bereits Erfahrungen mit Eisenoxid-Nanopartikeln und einem angewandten Magnetfeld, um die Wände der Blutgefäße gerade so weit zu öffnen, dass großmolekulare Medikamente durchgelassen werden konnten.
"Wir wussten wirklich nicht, ob das für die Genbearbeitung funktionieren würde oder nicht, aber wir dachten, dass es einen Versuch wert ist", sagte Bao.
Die Forscher nutzen die magnetischen Nanopartikel, um BV zu aktivieren und Gen-Editing-Nutzlasten nur dort zu liefern, wo sie gebraucht werden. Dazu nutzen sie ein Immunsystem-Protein namens C3, das normalerweise Baculoviren inaktiviert.
"Wenn wir BV mit magnetischen Nanopartikeln kombinieren, können wir diese Deaktivierung durch Anlegen des Magnetfeldes überwinden", sagte Bao. "Das Schöne ist, dass bei der Entbindung die Gentechnik nur am Gewebe oder am Teil des Gewebes stattfindet, wo wir das Magnetfeld anlegen."
Die Anwendung des Magnetfeldes ermöglicht die BV-Transduktion, den Nutzlastzufuhrprozess, der die Gen-Editierung von Fracht in die Zielzelle einführt. Die Nutzlast ist ebenfalls DNA, die sowohl ein Reportergen als auch das CRISPR/Cas9-System kodiert.
In Tests wurde das BV mit grün fluoreszierenden Proteinen oder Glühwürmchen-Luciferase beladen. Zellen mit dem Protein leuchteten unter dem Mikroskop hell, und Experimente zeigten, dass die Magnete bei der gezielten Lieferung von BV-Frachten in Zellkulturen und Labortieren sehr effektiv waren.
Bao bemerkte, dass seine und andere Labore an der Lieferung von CRISPR/Cas9 mit adeno-assoziierten Viren (AAV) arbeiten, aber er sagte, dass die Kapazität von BV für therapeutische Ladung ungefähr achtmal größer ist. "Es ist jedoch notwendig, die BV-Transduktion in Zielzellen effizienter zu gestalten", sagte er.