Mathematik klärt Reaktionen des Immunsystems auf
Bei einer Infektion mit dem Grippevirus Influenza ist der Körper besonders anfällig für andere Krankheitserreger. Bakterien wie Streptococcus pneumoniae, Auslöser der Lungenentzündung, haben dann mit dem Immunsystem leichtes Spiel und breiten sich besonders stark aus. Dies kann mitunter sogar zum Tod führen. Allerdings sind die Gründe für die rasante Vermehrung der Bakterien bei einer Doppelinfektion mit Grippeviren bislang nicht genau bekannt. Nun haben Wissenschaftler des Helmholtz-Zentrums für Infektionsforschung (HZI) in Braunschweig und der Otto-von-Guericke-Universität Magdeburg (OVGU) in einem interdisziplinären Projekt herausgefunden, dass bei einer Doppelinfektion die Überproduktion eines bestimmten Botenstoffes die Vermehrung der Bakterien zu begünstigen scheint.
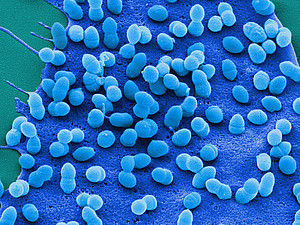
Bakterien der Art Streptococcus pneumoniae besiedeln eine Endothelzelle.
HZI/M. Rohde
Bis zu 20.000 Menschen sterben pro Jahr allein in Deutschland an den Folgen einer Grippeerkrankung. Dabei führt allerdings in den meisten Fällen nicht das Grippevirus zu schwerwiegenden Komplikationen, sondern eine bakterielle Zweitinfektion, die die Patienten nach dem Ausbruch der Grippe erworben haben. Ein Bakterium, das häufig den grippegeschwächten Körper befällt, ist Streptococcus pneumoniae, das schwere Lungenentzündungen auslösen kann. In Kombination mit einer Grippe verläuft diese Infektion besonders schwer und ist dann sogar lebensbedrohlich. Durch welche Prozesse eine Grippe die Anfälligkeit für bakterielle Infektionen und deren Ausprägung beeinflusst, war bislang nicht geklärt.
In einem interdisziplinären Ansatz haben die Teams um Dunja Bruder, Leiterin der HZI-Arbeitsgruppe Immunregulation und Professorin für Infektionsimmunologie an der OVGU Magdeburg, und Dr. Esteban A. Hernandez-Vargas, der die Arbeitsgruppe Systemmedizin der Infektionskrankheiten am HZI leitet, einen Beitrag zur Entschlüsselung dieses Rätsels geleistet. Gemeinsam haben die Wissenschaftler einen Projektplan entwickelt, der die Laborarbeit mit Mäusen, die gleichzeitig mit dem Grippevirus und Streptococcus pneumoniae infiziert waren, mit computergebundener Modellierung der Infektionsprozesse verknüpft. „Üblicherweise simulieren wir biologische Prozesse aus bereits publizierten Daten. Da wir Systembiologen am HZI eng mit Infektionsforschern vor Ort zusammenarbeiten, war es möglich, die Infektionsversuche genau so zu planen, dass sich die gezielt erhobenen Daten ideal für die mathematische Modellierung der Infektionsverläufe eignen würden“, sagt Hernandez-Vargas. In Infektionsexperimenten konnten Bruder und ihr Team zeigen, dass bereits 18 Stunden nach der Infektion grippekranker Mäuse mit den Bakterien die Anzahl der Makrophagen – Immunzellen, die Krankheitserreger beseitigen – rapide einbricht, während sich die Bakterien rasant vermehren.
Die beobachtete Zunahme der Pneumokokken und die gleichzeitige Abnahme der Immunzellen beschrieben die Systembiologen mit mathematischen Funktionen und stellten dabei fest, dass beide Entwicklungen nicht genau zueinander passten. „Daraus konnten wir ableiten, dass sich die Bakterien nicht nur deshalb so stark vermehren konnten, weil die Zahl der Makrophagen zurückging. Es musste also noch mindestens ein weiterer Faktor eine Rolle spielen“, sagt Dunja Bruder.
Im nächsten Schritt schauten sich die Wissenschaftler die Ausschüttung verschiedener Botenstoffe an, die bei der Abwehr bakterieller Infektionen wichtige Funktionen übernehmen. Auch für die Untersuchung dieser Moleküle wurden zuvor genaue Zeitpunkte für die Probennahme festgelegt, damit die gewonnenen Daten eine möglichst gute mathematische Simulierung der Prozesse zulassen. Dabei fiel zunächst auf, dass die vom Körper produzierte Menge der Botenstoffe bei einer Doppelinfektion deutlich größer war als bei einer bakteriellen Infektion allein. Wieder hat Hernandez-Vargas‘ Team die Entwicklung der Bakterienzahl, der Anzahl der Makrophagen und der verschiedenen Botenstoffe in seine mathematischen Modelle eingespeist. Die beste Übereinstimmung ergab sich mit den Messdaten des Botenstoffs Interferon gamma, ein geringer Einfluss ließ sich außerdem für Interleukin 6 nachweisen – beides Moleküle, die normalerweise bei einer Infektion wichtig sind für die Steuerung der Immunabwehr.
„Durch die Infektion mit den Grippeviren ist das Level von Interferon gamma bereits hoch. Kommt dann eine Zweitinfektion mit Pneumokokken hinzu, wird noch mehr Interferon gamma produziert. Basierend auf unseren Ergebnissen gehen wir davon aus, dass infolge dieser Überreaktion des Immunsystems die Makrophagen die Bakterien nicht mehr effektiv beseitigen können. Denn bekanntermaßen wird deren „Fressfunktion“ durch zu viel Interferon gamma beeinträchtigt“, erklärt Bruder. Bestätigt wird diese Annahme auch durch eine Computersimulation: Entzieht man dem Modell das gesamte Interferon gamma, bleibt die starke Vermehrung der Bakterien aus. Die Ergebnisse dieser Simulation wollen die Wissenschaftler um Dunja Bruder nun auch experimentell im Labor überprüfen. „Wenn die experimentellen Ergebnisse mit denen aus der Modellierung gewonnenen übereinstimmen, haben wir mit dem mathematischen Modell tatsächlich ein Werkzeug, mit dem sich die Rolle bestimmter Botenstoffe in Infektionsprozessen vorhersagen lässt“, sagt Hernandez-Vargas. „Das hätte zum einen den Vorteil, dass sich Laborexperimente deutlich besser planen und sich so auch Tierversuche reduzieren ließen. Zum anderen ließe sich langfristig eine Therapie für Doppelinfektionen entwickeln, die am Interferon ansetzt.“