Speck durch Stress?
Stresshormone begünstigen Diabetes und Übergewicht im Alter
Dass Stress im Körper Entzündungsreaktionen auslösen und krank machen kann, ist in der Medizin längst bekannt. Wissenschaftler der Universitäten Ulm und Wien haben nun herausgefunden, warum Stresshormone wie das Cortisol zudem einen massiven Einfluss auf den Fettstoffwechsel haben. Sie sind dabei auf einen molekularen Mechanismus gestoßen, der die Entstehung von Übergewicht und Diabetes im Alter erklären kann.

cocoparisienne, pixabay.com, CC0
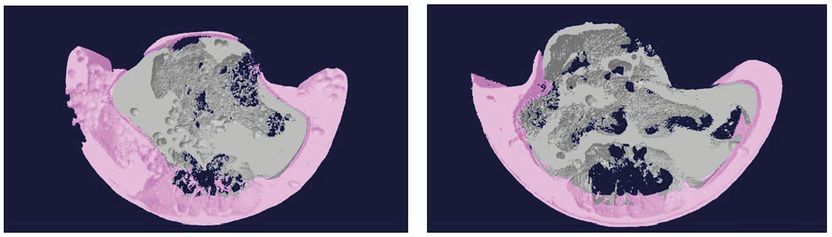
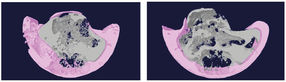
Die Mäuse mit blockiertem Cortisol-basierten Stresssignal (rechts) haben nach der Fettdiät einen niedrigeren Anteil an Unterhautfett (rosa) aber auch messbar weniger Bauchhöhlenfett (grau); Rekonstruktion auf der Grundlage von Mikro-Computertomographie-Daten
Dr. Kerstin Hartmann

„Wir haben dafür in den Fettzellen die Weiterleitung von bestimmten Stresssignalen blockiert und dann beobachtet, wie sich dadurch Zuckerstoffwechsel sowie Fettaufbau und Fettabbau verändern“, erklärt Professor Jan Tuckermann, der Leiter des Instituts für Molekulare Endokrinologie der Tiere an der Universität Ulm. Im Fokus stand dabei die Wirkung von Cortisol. Das Stresshormon, das zur biochemischen Klasse der Glucocorticoide gehört, spielt nicht nur eine Schlüsselrolle bei der Unterdrückung von Entzündungsreaktionen, sondern steuert zudem in Stress- und Gefahrensituationen die Mobilisierung von Energie.
Dieses Hormon wirkt über einen Glucocorticoid-Rezepter (GR), der im Zytoplasma der Zellen sitzt. Wenn er aktiviert wird, dringt er in den Zellkern ein und reguliert dort die genetische Aktivität. „Um herauszufinden, wie wichtig die Cortisolwirkung für den Stoffwechsel ist, haben wir dieses Rezeptormolekül in den Fettzellen von Mäusen gentechnisch deaktiviert und damit das Cortisol-vermittelte Stresssignal blockiert“, erläutert Dr. Kerstin Hartmann. Die wissenschaftliche Mitarbeiterin aus dem Ulmer Tuckermann-Labor, die jetzt bei der Firma BioNTech Diagnostics arbeitet, teilt sich die Erstautorenschaft der im Fachjournal „Diabetes“ veröffentlichten Studie mit Dr. Kristina Müller vom Ludwig Boltzmann Institut für Krebsforschung in Wien.
Am Wiener Boltzmann-Institut wurde untersucht, wie sich die Blockade des Stresshormonrezeptors auf den Stoffwechsel dieser Mäuse auswirkt, wenn diese auf Reduktionsdiät gesetzt sind. „Aufgrund der blockierten Stressantwort können diese Mäuse beim Fasten die Energiereserven aus den Fettzellen nicht verwerten. Zum Ausgleich greift der Körper auf andere Energiequellen zurück, was zu einer fundamentalen Störung des gesamten Stoffwechsels führt“, so Professor Richard Moriggl, Direktor des Ludwig Boltzmann Instituts für Krebsforschung, der gemeinsam mit Jan Tuckermann das Forschungsprojekt federführend geleitet hat.
Was dagegen passiert, wenn Mäuse mit blockiertem GR-Rezeptor einer äußerst fettreichen Diät unterzogen werden oder wenn sie einfach nur altern, haben die Ulmer Wissenschaftler analysiert. Denn wie beim Menschen steigt auch bei der Maus mit dem Alter normalerweise der Körperfettanteil. „In der Studie zeigt sich, dass die Mäuse mit blockiertem Stresssignal viel schlanker waren als die jeweilige Wildtyp-Vergleichsgruppe, und zwar sowohl die alten, als auch die besonders fettreich ernährten“, berichtet Tuckermann. Dabei waren nicht nur die Fettdepots kleiner, sondern auch die Fetteinlagerung in der Leber deutlich geringer als bei den Mäusen, deren Cortisolsignalweg in den Fettzellen ungehindert funktionierte. Und auch der Zuckerhaushalt der genetisch modifizierten Mäuse hatte sich deutlich verbessert. Die Folge: ein wesentlich niedrigeres Diabetesrisiko. „Aus diesen Ergebnissen leitet sich im Umkehrschluss ab, dass Stresshormone die Gewichtszunahme beschleunigen und Alterdiabetes begünstigen können“, sagen die Ulmer und Wiener Forscher, die bei dieser Studie von Wissenschaftlern des Helmholtz Diabetes Center in München und der Grazer Biotech-Firma Joanneum Research unterstützt wurden.
Was ist nun die medizinische Relevanz der von der Deutschen Forschungsgemeinschaft (DFG) und der EU geförderten Untersuchung? Altersassoziierte Erkrankungen wie Fettleibigkeit gehen mit einer ganzen Reihe an schwerwiegenden Begleiterkrankungen einher. Dazu gehören Herzkreislauferkrankungen wie Herzinfarkt und Schlaganfall, aber auch Stoffwechselkrankheiten wie Diabetes. „Wenn es nun gelingt herauszufinden, welche Rolle hier Stresshormone wie das Cortisol spielen, die zwischen entzündlichen und metabolischen Prozessen vermitteln, können wir möglicherweise neue Anknüpfungspunkte finden, um über die beteiligten Signalwege krankhaft veränderte Stoffwechselprozesse positiv zu beeinflussen“, glaubt Tuckermann.