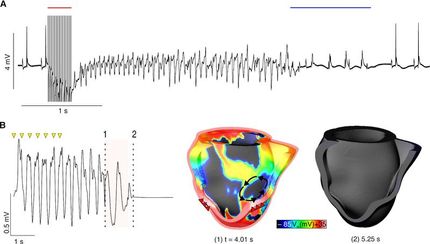
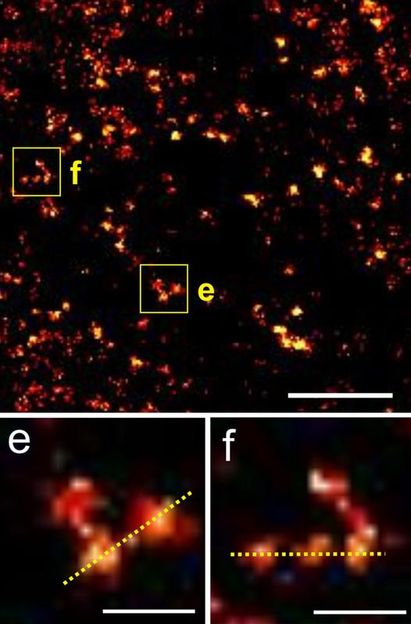
Erstmals molekularer Blick in atriale Herzmuskelzellen
Neuartige Signalprozesse und auch Krankheitsursachen können so grundlegend erklärt werden
Rund zwei Drittel aller Herzrhythmusstörungen insbesondere bei älteren Menschen haben ihren Ursprung im Herzvorhof. Hier sind die „atrialen“ Herzmuskelzellen des Vorhofs entscheidend für die Füllung der Herzkammern. Doch bisher wurden diese Herzmuskelzellen kaum gezielt mit modernsten zellbiologischen Methoden untersucht. Sören Brandenburg und Prof. Dr. Stephan Lehnart, beide Klinik für Kardiologie und Pneumologie der Universitätsmedizin Göttingen (UMG), ist es nun weltweit erstmals gelungen, die molekularen Zellstrukturen sogenannter atrialer Kardiomyozyten sichtbar zu machen.
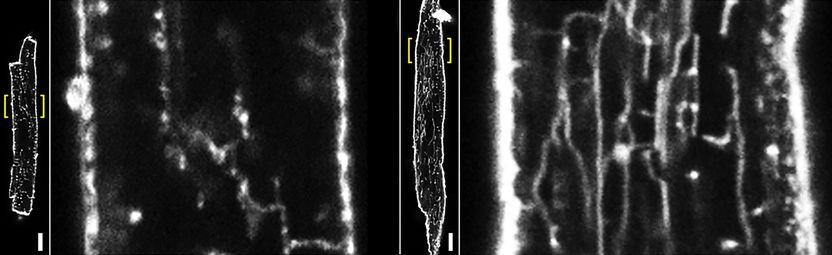
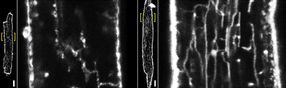
Lebendzell-Membranverfärbung von gesunden und kranken atrialen Maus-Herzmuskelzellen. Zur Darstellung kommt das Tubulus-Netzwerk in der Kontrollzelle (links vergrößert) sowie in der pathologisch vergrößerten Zelle nach Aortenstenose (rechts vergrößert). Die längsgerichteten Tubuli sind im Bild als vertikale Strukturen sichtbar. Maßstab 10 µm.
Foto: umg
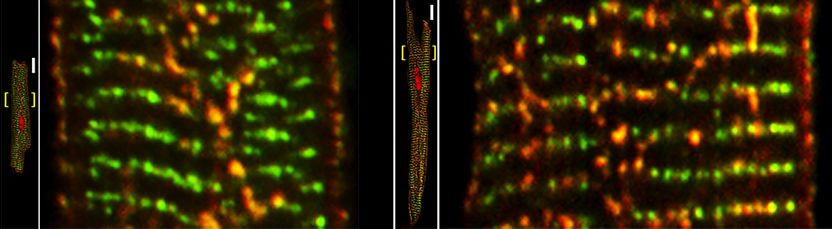
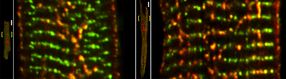
Zeitgleich zur Proliferation der axialen Tubuli (vorheriges Bild) steigt die Anzahl hoch-phosphorylierter RyR2-Calcium-Freisetzungskanäle (sichtbar als gelbe Strukturen in den vergrößerten Bildern) im direkten Vergleich zwischen der Kontroll- (links) und der pathologisch vergrößerten atrialen Herzmuskelzelle (rechts). Niedrig-phosphorylierte RyR2-Calciumkanäle erscheinen dagegen als grün markierte Cluster-Strukturen. Maßstab 10 µm.
Foto: umg
Nach neuen Erkenntnissen werden atriale Herzmuskelzellen von spezialisierten und elektrisch erregbaren Membranschläuchen, dem sog. Tubulus-Netzwerk, durchzogen. Das schlauchartige Membransystem durchzieht die atrialen Zellen auf ungewöhnliche Weise. Bislang war unklar, wie elektrische Signale die Kontraktion der atrialen Herzmuskelzelle auslösen und wie die Kontraktion abläuft. „Wir konnten nun zeigen, wie das elektrische Aktionspotential durch die Tubulus-Strukturen bis tief in die Zelle hineingelangt und wo die Zelle im Inneren genau durch die Freisetzung von Ca²+-Ionen stimuliert wird. Ein besseres Verständnis dieser subzellulären Signalmechanismen ermöglicht auch detaillierte Vorhersagen bei Krankheiten, wenn die Signalprozesse gestört sind. Dies ist z.B. bei Herzrhythmusstörungen der Fall“, sagt Sören Brandenburg, Erstautor der Studie.
Die Göttinger Forscher haben zunächst Herzmuskelzellen von genetisch veränderten Mäusen untersucht und dann ihre molekularen Ergebnisse in menschlichen Herzmuskelzellen bestätigt. Das von ihnen erstmals beschriebene und Vorhofzellen-spezifische tubuläre Membrannetzwerk besteht (im Gegensatz zu Muskelzellen der ventrikulären Herzkammern) hauptsächlich aus längs zur Zellachse ausgerichteten Tubulus-Nanostrukturen. Diese kleinsten Strukturen waren mit Hilfe modernster Mikroskopie-Verfahren, wie Stimulated Emission Depletion (STED) und Elektronentomographie, messbar. Die Göttinger Forscher konnten sichtbar machen, wo diese „axialen“ Membrantubuli mit besonders vielen Calcium-Freisetzungskanälen, sog. Ryanodin-Rezeptoren, assoziiert sind, die das Calcium-Signal und damit direkt die Kontraktion der Zelle maßgeblich beeinflussen.
Prozesse verstehen, um neue Therapieansätze entwickeln zu können
Ein gemeinsam mit den amerikanischen Wissenschaftlern Prof. Jonathan Lederer, Prof. George Williams und Prof. Christopher Ward der University of Maryland in Baltimore entwickeltes Computermodell simuliert erstmals die Calcium-Signale atrialer Zellen. So lässt sich beispielsweise folgende Frage beantworten: Wie wird im Zellinneren ein besonders schnelles lokales Calcium-Signalverhalten durch axiale Tubulus-Strukturen vermittelt? Das Modell soll helfen, diese sehr schnellen Signalprozesse noch besser zu verstehen und in Zukunft neue Therapieansätze entwickeln zu können. Das Göttinger Forscherteam konnte im Mausmodell zeigen, welche Auswirkungen eine pathologische Zunahme der Herzmuskeldicke induziert durch Aortenstenose auf atriale Herzmuskelzellen hat. „Die atrialen Zellen wurden dabei nicht nur deutlich größer, auch die Zahl der axialen Tubulus-Strukturen nahm deutlich zu. Diese strukturellen Veränderungen haben einen wichtigen Einfluss auf Calcium-Signale und können eine wichtige Rolle für die Entwicklung von Herzrhythmusstörungen spielen. Wir haben jetzt die Möglichkeit, diese Signal-Prozesse vorherzusagen und zu überlegen, welche Substanzen oder Therapieverfahren helfen könnten, nachteilige atriale Remodeling-Prozesse zu verhindern“, sagt Prof. Lehnart, Seniorautor der Studie. Die Idee dahinter: Werden entscheidende krankheitsauslösende Veränderungen in atrialen Zellen frühzeitig gehemmt, können Folgeerkrankungen wie Vorhofflimmern und Schlaganfälle möglicherweise verhindert werden.
Originalveröffentlichung
Sören Brandenburg, Tobias Kohl, George S.B. Williams, Konstantin Gusev, Eva Wagner, Eva A. Rog-Zielinska, Elke Hebisch, Miroslav Dura, Michael Didié, Michael Gotthardt, Viacheslav O. Nikolaev, Gerd Hasenfuss, Peter Kohl, Christopher W. Ward, W. Jonathan Lederer and Stephan E. Lehnart; "Axial tu-bule junctions control rapid calcium signaling in atria"; The Journal of Clinical Investigation; 2016
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.

Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.