Alzheimer-Toxine legen Kraftwerke der Zelle lahm
Forscher der Universität Bonn haben einen Mechanismus entschlüsselt, der womöglich entscheidend zur Entstehung der Alzheimer-Erkrankung beiträgt. Demnach scheinen Alzheimer-Toxine den Nachschub wichtiger Proteine in die Mitochondrien von Nervenzellen zu verhindern. Diese stellen daraufhin die Energieversorgung nach und nach ein, vermuten die Wissenschaftler. Ohne Energie sind die Zellen dem Untergang geweiht.
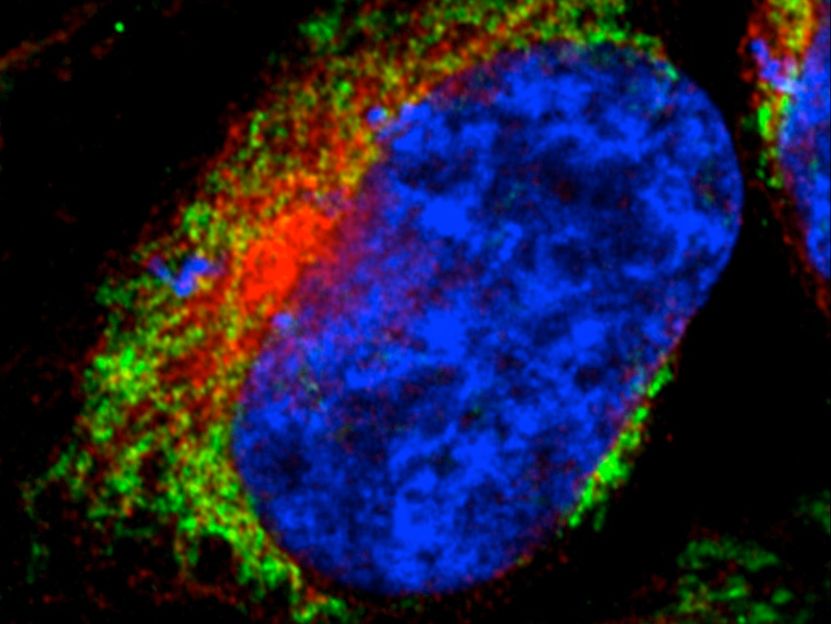
Die Immun-Fluoreszenzaufnahme einer menschlichen Zelle zeigt das Netzwerk der Mitochondrien (grün). Zum Vergleich sind der Zellkern in blau und das Endoplasmatische Retikulum in rot angefärbt.
(c) AG Voos, Universität Bonn
Im Gehirn von Alzheimer-Kranken finden sich zwischen den Nervenzellen charakteristische Ablagerungen, die so genannten Plaques. Diese bestehen aus Beta-Amyloiden – das sind kurze Eiweiß-Ketten. Beta-Amyloide kommen auch in Gesunden vor, werden dort aber schnell abgebaut.
Bei Alzheimer-Patienten häufen sie sich dagegen an. In den Plaques finden sich daher große Mengen von miteinander verknäulten Beta-Amyloiden. Lange Zeit dachte man, dass diese extrazellulären Ablagerungen die Nervenzellen schädigen und schließlich abtöten. Nach dieser Lesart sind also die Plaques für die fortschreitende Demenz verantwortlich.
Inzwischen mehren sich Stimmen, die das bezweifeln. So weiß man heute, dass auch innerhalb der Nervenzellen Beta-Amyloide vorkommen. Viele Forscher vermuten, dass sie dort ihre toxische Wirkung entfalten, indem sie bestimmte Bestandteile der Zelle schädigen. Zu dieser These passt ein weiterer Befund: In den Nervenzellen von Alzheimer-Erkrankten sind oft die Mitochondrien defekt. Mitochondrien fungieren als „Minikraftwerke“: Sie liefern die Energie, die die Zelle für ihre Aufgaben benötigt.
Isolierte Mitochondrien mit Beta-Amyloiden versetzt
„Wir haben in unserer Arbeit untersucht, ob Beta-Amyloide die Mitochondrien schädigen können“, erklärt Professor Dr. Wolfgang Voos vom Institut für Biochemie und Molekularbiologie der Universität Bonn. „Dazu haben wir unter anderem isolierte Mitochondrien mit Beta-Amyloiden versetzt und getestet, welche Prozesse dadurch gestört werden.“
Direkte Schäden an den Mitochondrien konnten die Wissenschaftler nach dieser Behandlung nicht feststellen. Die Zellkraftwerke waren völlig intakt. „Wir haben aber einen anderen Effekt gefunden“, erläutert Voos: „Die Beta-Amyloide unterbinden den Transport von Proteinen in die Mitochondrien.“
Mitochondrien benötigen für ihre komplexe Aufgabe rund 1.000 verschiedene Proteine. Gerade einmal 13 davon können sie selbst herstellen. Die restlichen werden im Cytoplasma der Zelle produziert. Die Mitochondrien nehmen sie von dort mit Hilfe spezieller Transporter-Moleküle auf ihrer Oberfläche auf. Diese Aufnahme wird von den Beta-Amyloiden gehemmt – und zwar extrem effektiv. „Ich habe im Laufe meines Forscherlebens selten eine solch starke Blockade des Proteintransports gesehen“, betont Voos.
Ständiger Verschleiß
Ähnlich wie eine komplizierte Maschine unterliegen auch Mitochondrien einem ständigen Verschleiß. Viele ihrer Bestandteile haben nur eine begrenzte Lebensdauer und müssen daher regelmäßig ersetzt werden. Ohne diesen Nachschub verarmen die Zellkraftwerke unter anderem nach und nach an den Enzymen, die sie zur Energieerzeugung brauchen. Irgendwann bricht die Energieproduktion völlig zusammen – die Zelle stirbt. „Dieser Mechanismus kann womöglich entscheidend zu dem massenhaften Untergang von Neuronen beitragen, der für die Alzheimer-Demenz charakteristisch ist“, sagt Voos.
Allerdings ist noch unklar, ob sich die Ergebnisse aus dem Reagenzglas auf ganze Zellen oder gar Alzheimer-Kranke übertragen lassen, schränken die Forscher ein. „Wir wollen nun in einem nächsten Schritt herausfinden, ob wir die Blockade des Protein-Transports auch in den Nervenzellen von Patienten finden“, erklärt Voos.