Wie ein kleines Molekül die Entfernung von überschüssigem Cholesterin fördert
Wissenschaftler haben die Struktur der aktivierten Form eines Enzyms bestimmt, das hilft, überschüssiges Cholesterin in die Leber zurückzuführen.
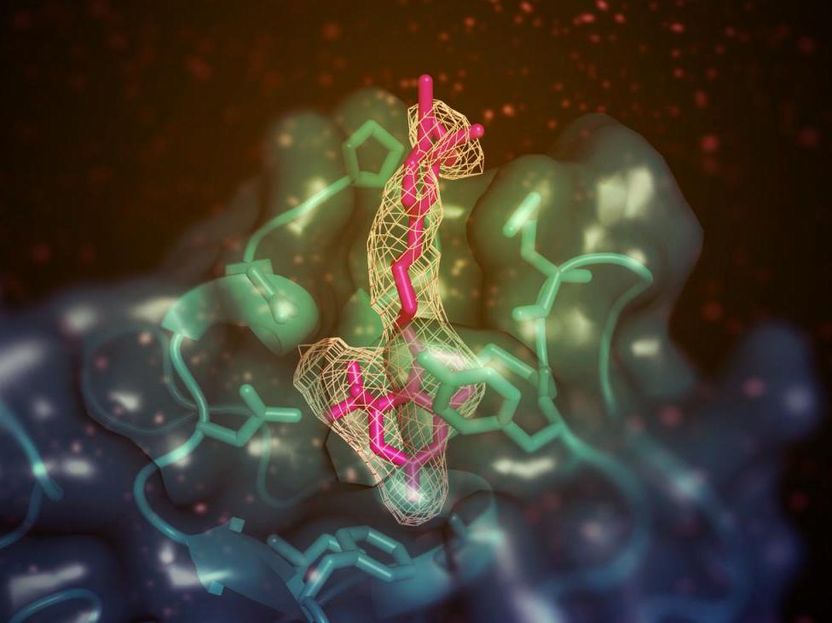
Ein kleines Molekül (hier in Pink) mit der Fähigkeit, den "guten" (HDL) Cholesterinspiegel in Tiermodellen zu erhöhen, bindet an die membranbindende Domäne der Lecithin:cholesterin Acyltransferase (LCAT; in Blaugrün dargestellt). Der Standort ist von der aktiven Stelle des Enzyms entfernt, ermöglicht aber irgendwie den Transfer von Lipidsubstraten aus HDL.
Kelly Manthei and Stephanie King
Die Forschung zeigt, wie eine medikamentenähnliche Chemikalie die Wirkung des Enzyms Lecithin:Cholesterin Acyltransferase (LCAT) stimuliert. Es deutet auch darauf hin, dass zukünftige Medikamente, die den gleichen Mechanismus verwenden, verwendet werden könnten, um die LCAT-Funktion bei Menschen mit familiärem LCAT-Mangel (FLD) wiederherzustellen, einer seltenen Erbkrankheit, die sie einem Risiko für Augenprobleme, Anämie und Nierenversagen aussetzt.
LCAT hilft dem hochdichten Lipoprotein (HDL) - bekannt als das "gute" Cholesterin - Cholesterin aus dem Blut zu entfernen, indem es das Lipid in eine Form umwandelt, die sich leichter verpacken und transportieren lässt. Es sind mehr als 90 Mutationen in LCAT bekannt, die entweder einen teilweisen Aktivitätsverlust (bekannt als "Fischaugenkrankheit") oder einen Vollverlust (FLD) verursachen können. Die Steigerung der LCAT-Aktivität könnte daher bei der Behandlung von Menschen mit koronarer Herzkrankheit und LCAT-Mangel von Vorteil sein, aber die Mechanismen, mit denen sie aktiviert werden kann, sind kaum verstanden.
"In dieser Studie haben wir die Strukturbiologie genutzt, um zu verstehen, wie ein patentierter LCAT-Aktivator an LCAT bindet und wie er den Cholesterintransport fördert", sagt die Hauptautorin Kelly Manthei, Postdoktorandin am University of Michigan Life Sciences Institute, USA. "Wir fragten auch, ob die Verbindung helfen könnte, die Aktivität von LCAT-Enzymen wiederherzustellen, die häufig Mutationen beobachtet haben, die bei FLD beobachtet wurden."
Das Team betrachtete mit Hilfe der Röntgenkristallographie das LCAT-Enzym, das in seinem aktiven Zustand mit zwei verschiedenen Chemikalien stabilisiert wurde - dem Aktivatormolekül und einer zweiten Verbindung, die ein an das Enzym gebundenes Substrat imitiert. Die beiden Chemikalien hatten mehr Einfluss auf das Protein, wenn sie zusammen präsentiert wurden, als wenn sie getrennt präsentiert wurden, was darauf hindeutet, dass sie an verschiedenen Stellen an das Enzym binden.
Weitere Analysen ergaben, dass das Aktivatormolekül, im Gegensatz zu anderen bekannten LCAT-Aktivatoren, an eine Region in der Nähe der HDL-Bindung bindet. Der Aktivator half LCAT jedoch nicht, sich effektiver an die HDL zu binden, was das Team zu der Vermutung veranlasste, dass es stattdessen dazu beiträgt, Cholesterin und Lipide in das katalytische Zentrum des Enzyms zu transferieren, so dass es sie in Fracht für den Transport in HDL umwandeln kann.
Nachdem sie diese Wirkungsweise etabliert hatten, testeten die Forscher, ob dieses Molekül helfen könnte, die Cholesterin-Transportfunktion eines mutierten LCAT-Enzyms wiederherzustellen. Sie machten eine Version des Enzyms mit einer Mutation, die bei FLD-Patienten häufig vorkommt, und testeten dann seine Fähigkeit, sich an HDL zu binden und Cholesterin in Gegenwart oder Abwesenheit des Aktivatormoleküls umzuwandeln. Sie waren begeistert, dass der Aktivator den Aktivitätsverlust in den mutierten Enzymen teilweise rückgängig machen konnte, was zu einer vergleichbaren Cholesterin-Konversion mit dem normalen Enzym führte.
"Unsere Ergebnisse werden den Wissenschaftlern helfen, Verbindungen zu entwickeln, die besser auf LCAT abzielen, so dass sie für Herzerkrankungen und FLD-Patienten von therapeutischem Nutzen sein könnten", schließt Senior-Autor John Tesmer, Walther-Professor für Krebsstrukturbiologie an der Purdue University, USA. "Zukünftige Bemühungen werden sein, zu untersuchen, ob Patienten mit anderen LCAT-Genmutationen von den in dieser Studie verwendeten Verbindungen profitieren könnten, und Moleküle mit verbesserten pharmakologischen Eigenschaften für die weitere Entwicklung zu entwickeln."
Originalveröffentlichung
Kelly A Manthei, Shyh-Ming Yang, Bolormaa Baljinnyam, Louise Chang, Alisa Glukhova, Wenmin Yuan, Lita A Freeman, David J Maloney, Anna Schwendeman, Alan T Remaley, Ajit Jadhav, John JG Tesmer; "Molecular basis for activation of lecithin:cholesterol acyltransferase by a compound that increases HDL cholesterol"; eLife; 2018