Große Ergebnisse aus kleinen Lösungen
Neues Verfahren zur Analyse von Metalloproteinen
Eine neue Methode benötigt nur eine winzige flüssige Probe, um Metalloproteine zu analysieren. Dieser Durchbruch wurde von einem Forschungsteam unter der Leitung von Associate Professor Eiji Ohmichi und Tsubasa Okamoto an der Kobe University Graduate School of Science erzielt.
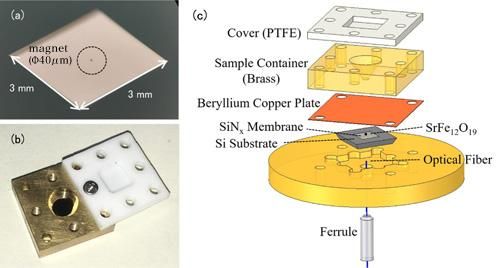
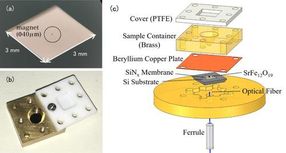
(a) Foto einer Nanomembran. Die Nanomembran selbst ist sehr dünn (100 nm), so dass sie für das bloße Auge transparent erscheint. Der in der Mitte umschlossene Gegenstand ist ein winziger Magnet zur EPR-Erkennung. (b) Foto der Lösungszelle. Der Behälter ist mit einem Teflondeckel versehen, um ein Verdampfen der Lösungsprobe zu verhindern. (c) Der Versuchsaufbau der kraftdetektierten EPR-Spektroskopie. Die Lösungszelle mit der Messprobe wird mit angebrachten Magneten über der Membran platziert. Veränderungen in der Nanomembran werden durch die Glasfaser unterhalb der Membran erfasst.
Kobe University
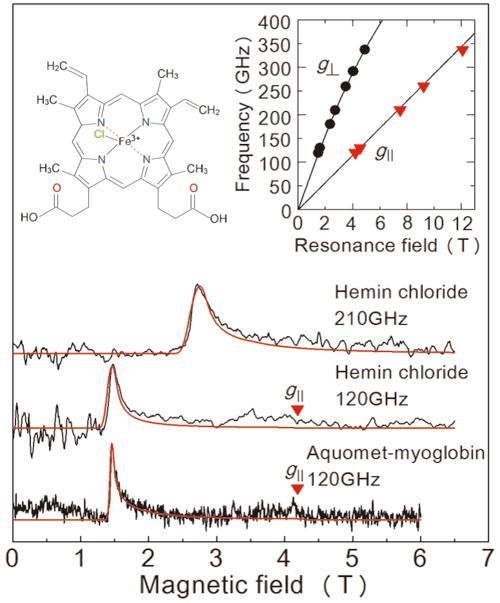
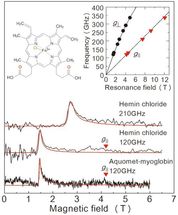
Ergebnisse der EPR-Messungen, die in dieser Studie aus einer gefrorenen Lösungsprobe gewonnen wurden. Die beiden oberen Diagramme beziehen sich auf Häminchlorid, und die untere Grafik bezieht sich auf Myoglobin. Die rote Linie ist ein projiziertes Signal von einem Wertesimulator. Die Lösungskonzentrationen und Probenvolumina betrugen 50 mM/2 μL für Heminchlorid und 8,8 mM/10 μL für Myoglobin. Die Messungen fanden bei 4,2 K statt. Durch die Untersuchung der beiden Linien in der oberen rechten Grafik können wir den genauen Zustand der Eisenionen bestimmen. Die linke obere Grafik zeigt die Molekularstruktur von Heminchlorid.
Kobe University
Metalloproteine (auch bekannt als metallbindende Proteine) spielen in unserem Körper eine wichtige Rolle für den Sauerstofftransport und -speicherung, den Elektronentransport, die Oxidation und Reduktion. In vielen Fällen sind die Metallionen in diesen Proteinen die aktiven Zentren für diese Aktivitäten, so dass wir durch die genaue Identifizierung des Zustands dieser Ionen die Mechanismen hinter ihren Funktionen verstehen können.
Eine experimentelle Methode namens Electron Paramagnetic Resonance (EPR) kann verwendet werden, um den Zustand von Elektronen in Proteinen zu messen. Effektive EPR-Techniken erfordern für empfindliche Messungen eine bestimmte Menge an Probenvolumen. Viele Metalloproteine sind jedoch schwer zu isolieren und zu veredeln, so dass wir nur kleine Proben erhalten können.
Herkömmliche EPR-Messungen erfassen die von Metallionen absorbierten elektromagnetischen Wellen. Das bemerkenswerte Merkmal dieser Studie ist die Verwendung eines trampolinförmigen Gerätes, einer Nanomembran. Im EPR geht der Elektronenspin durch Absorption elektromagnetischer Wellen in einen energiereichen Zustand über, gleichzeitig kehrt sich aber auch die Spinrichtung um, und auch die magnetischen Eigenschaften der Metallionen ändern sich. Vor dem Experiment befestigte das Forschungsteam winzige Magnete an der Nanomembran, so dass die Änderungen der Anziehungskraft zwischen den Magneten und den Metallionen in eine Kraft auf die Nanomembran umgewandelt werden, und dieses EPR-Signal wird erfasst. Da die Nanomembran sehr dünn ist (nur 100 nm (=0,1 μm), können wir kleine Kraftänderungen, die mit der EPR-Absorption einhergehen, empfindlich messen.
Die Lösungsprobe wird in eine Lösungszelle direkt über der Membran eingebracht. Das Zellvolumen beträgt nur 50μL(=0,05 cc), und das Team fügt etwa 1-10μL(0,001-0,01 cc) der Lösung zur Messung hinzu. Um ein Verdampfen der Lösung zu verhindern, ist die Zelle mit einem Harzdeckel abgedeckt. Bei diesem Verfahren ist die dünne und zerbrechliche Nanomembran unabhängig von der Lösungszelle, was den Probenwechsel erleichtert.
Um die Leistung dieses Aufbaus zu bewerten, führte das Team eine EPR-Messung über eine Hochfrequenz (über 0,1 THz) für ein eisenhaltiges Protein namens Myoglobin und seinen Modellkomplex Heminchlorid durch (Abbildung 2). Dem Team gelang es, EPR-Signale über eine breite Wellenfrequenz (0,1-0,35 THz) für eine 50 mM-Konzentration zu erfassen, 2μL Heminchloridlösung. Sie beobachteten auch ein charakteristisches EPR-Signal für eine 8,8 mM, 10μL Probe der Myoglobinlösung. Ein großer Vorteil dieses Verfahrens ist die Möglichkeit, über einen weiten Frequenzbereich zu messen, so dass es für Metalloproteine mit einer Vielzahl von magnetischen Eigenschaften geeignet ist.
Professor Ohmichi kommentiert: "Diese neue Methode ermöglicht es, den Zustand der Metallionen in einer winzigen Menge Metalloproteinlösung detailliert zu bestimmen. Möglicherweise können wir die Methode auf Metalloproteine anwenden, die bisher nicht gemessen werden konnten. So spielt beispielsweise in unserem Stoffwechsel ein Metalloprotein namens Peroxidase eine entscheidende Rolle, indem es Wasserstoffperoxid in Wasser umwandelt und unschädlich macht, aber die Details des Mechanismus für diesen reaktiven Prozess sind noch unklar. Die Ergebnisse dieser Studie können potenziell als führende Analysemethode eingesetzt werden, um Licht in diese Art von lebenswichtigem Phänomen zu bringen."