Künstliche Enzyme werden immer «natürlicher»
Wissenschaftler der Universität Basel, der ETH Zürich in Basel und des NCCR Molecular Systems Engineering haben ein künstliches Metalloenzym entwickelt, das innerhalb einer lebenden Zelle eine Reaktion katalysiert, die so in der Natur nicht vorkommt. Mit solchen Enzymen könnten erstmals neue nicht-natürliche Stoffwechselwege in lebenden Zellen erschaffen werden.
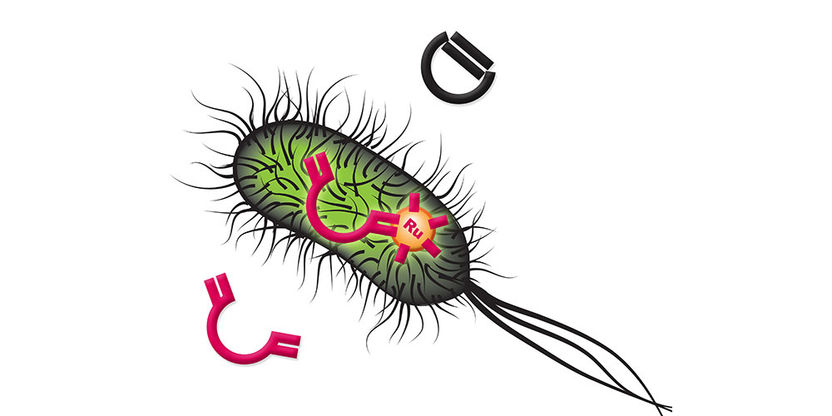
Darstellung der Alkenmetathese-Reaktion in E.coli mit einem rutheniumbasierten künstlichen Metalloenzym zur Herstellung neuer Chemikalien mit hohem Mehrwert.
NCCR Molecular Systems Engineering
Das künstliche Metalloenzym mit Namen biot-Ru-SAV wurde mit der sogenannten Biotin-Streptavidin-Technologie hergestellt. Dieses oft genutzte Verfahren beruht auf der starken Wechselwirkung zwischen dem Protein Streptavidin und dem Vitamin Biotin. Durch Bindung an Biotin kann man weitere Komponenten in das Protein einschleusen und so ein künstliches Enzym erzeugen. In der vorliegenden Arbeit wurde eine sogenannte metallorganische Verbindung gewählt, in der mindestens ein Kohlenstoffatom an ein Metallatom gebunden ist. Derartige Verbindungen werden oft als Katalysatoren in industriellen Prozessen verwendet, zeigen jedoch in wässrigen Lösungen oder in einem zellähnlichen Milieu keine oder nur eine geringe katalytische Funktion. Um diese Funktionseinschränkungen zu überwinden, müssen solche Katalysatoren in Gerüstproteine, wie zum Beispiel Streptavidin, eingebunden werden.
«Unser Ziel war es, ein künstliches Metalloenzym zu entwickeln, das eine Alkenmetathese katalysieren kann. Diese Reaktion findet sich nicht im Repertoire natürlicher Enzyme», sagt Thomas R. Ward, Professor am Departement Chemie der Universität Basel. Die Alkenmetathese ist ein Verfahren zur Bildung und Umverteilung von Kohlenstoff-Kohlenstoff-Doppelbindungen, das sowohl in der Forschung als auch in der industriellen Grossproduktion verschiedener chemischer Produkte breite Anwendung findet. Biot-Ru-SAV katalysiert eine Reaktion, bei der eine ringförmige Verbindung gebildet wird. Wegen ihrer fluoreszierenden Eigenschaften kann diese bei der Analyse einfach detektiert und quantifiziert werden.
Periplasma als Reaktionsraum
Das Milieu innerhalb einer lebenden Zelle ist jedoch bei weitem nicht ideal für das reibungslose Funktionieren metallorganyl-basierter Enzyme. «Der Durchbruch kam mit der Idee, das Periplasma von Escherichia coli als Reaktionsraum zu verwenden. Dieses Milieu ist für einen Alkenmetathesekatalysator viel besser geeignet», sagt Markus Jeschek, ein Forscher aus dem Labor von Sven Panke, Professor am Departement für Biosysteme, ETH Zürich in Basel. Das Periplasma ist ein Zellkompartiment zwischen der inneren Cytoplasmamembran und der äusseren Membran gramnegativer Bakterien und enthält nur eine niedrige Konzentrationen von Inhibitoren der Metalloenzyme, wie zum Beispiel Glutathion.
Nachdem sie die idealen in vivo Bedingungen für ihr Enzym gefunden hatten, gingen die Wissenschaftler noch einen Schritt weiter und optimierten biot-Ru-SAV durch sogenannte gerichtete Evolution. Diese Methode imitiert natürliche Prozesse zur Optimierung und Veränderung von Proteinen und deren Eigenschaften. «Wir konnten so ein einfaches und robustes Screening-Verfahren entwickeln, mit dem wir Tausende von biot-Ru-SAV-Mutanten testen und die aktivste Variante identifizieren konnten», erklärt Ward.
Den Wissenschaftlern ist es nicht nur gelungen, die katalytischen Eigenschaften von biot-Ru-SAV zu verbessern. Sie konnten auch zeigen, dass metallorganyl-basierte Enzyme verändert und optimiert werden können, um eine Vielzahl verschiedener chemischer Produkte herzustellen. «Das Spannende daran ist, dass künstliche Metalloenzyme wie biot-Ru-SAV dazu verwendet werden können, um neue Chemikalien mit hohem Mehrwert zu produzieren», sagt Ward. «Das hat ein grosses Potenzial zur Vereinigung chemischer und biologischer Werkzeuge, um letztendlich Zellen als molekulare Fabriken zu nutzen.»