Enzym mit eingebauter Bremse
Forscher schalten die Schwachstelle eines wertvollen biologischen Katalysators aus
Das natürlich in Zellen vorkommende Enzym DERA beschleunigt Reaktionen, aus denen begehrte Grundstoffe für Medikamente wie Cholesterin-Senker entstehen. Für die Pharmazeutische Industrie hätte es dadurch längst ein lukratives Werkzeug werden können. In der Praxis geht die Aktivität des Enzyms jedoch immer wieder verloren, sobald höhere Konzentrationen seines Reaktionspartners erreicht werden. Düsseldorfer und Jülicher Forscher entdeckten nun als Ursache einen unerwarteten, im Molekül eingebauten Blockade-Mechanismus, der durch minimale Veränderung der Enzymstruktur entfernt werden konnte.
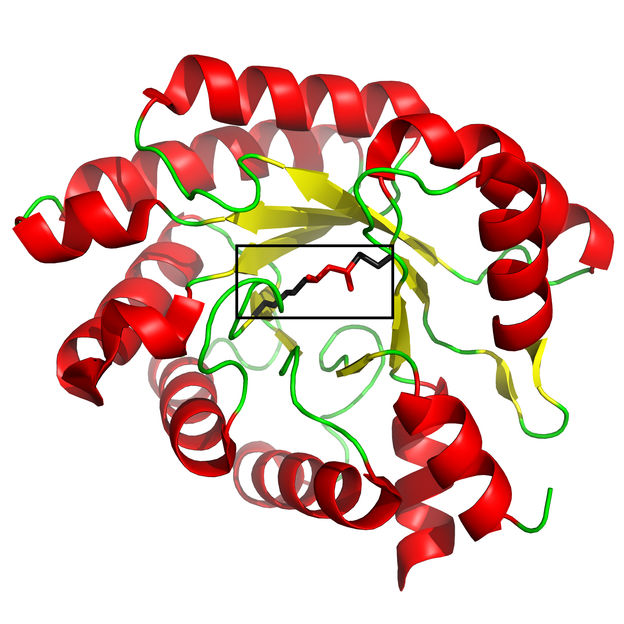
Globale Struktur des katalytischen Zentrums des DERA-Enzyms im deaktivierten Zustand.
Copyright HHU Düsseldorf/Forschungszentrum Jülich
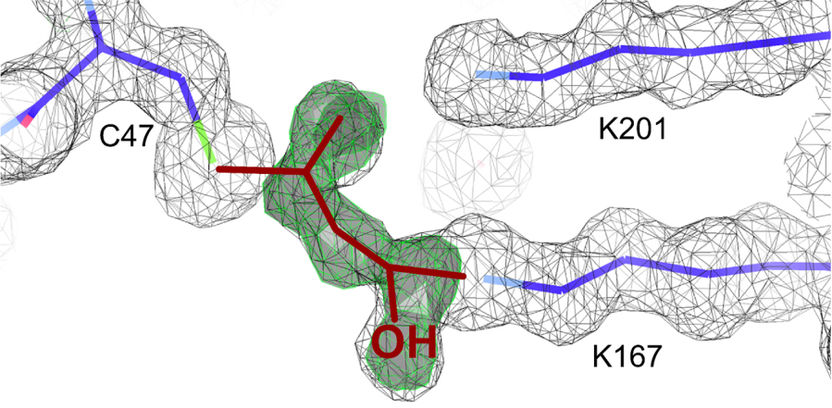
Nahaufnahme des katalytischen Zentrums des DERA-Enzyms im deaktivierten Zustand.
Copyright HHU Düsseldorf/Forschungszentrum Jülich
Enzyme sind hocheffiziente Werkzeuge der Natur, die Reaktionen stark beschleunigen oder überhaupt erst in Gang bringen. Viele Vorgänge im Körper benötigen die Unterstützung der natürlichen Katalysatoren, und auch für die Industrie bieten sie oft eine Präzision und Effizienz, die mit anderen chemischen Syntheseverfahren kaum zu erreichen ist. Allerdings ist den Proteinmolekülen, aus denen Enzyme bestehen, oft eine gewisse Fragilität zu eigen, die unter industriellen Bedingungen zu Schwierigkeiten führen kann.
Ein solcher Fall ist das Enzym DERA. Es katalysiert sogenannte Aldol-Reaktionen, bei denen Grundsubstanzen für verschiedene Medikamente aus dem günstigen Ausgangsstoff Acetaldehyd entstehen – etwa die Vorstufen von Statinen, die als Cholesterin-Senker einen Milliardenmarkt ausmachen. Doch leider arbeitet DERA nur bei relativ niedrigen Konzentrationen von Acetaldehyd. Wird ein bestimmter Schwellenwert überschritten, kommt die enzymatische Aktivität völlig zum Erliegen und kehrt auch nicht wieder, wenn die Konzentration wieder sinkt. "Ein Katalysator, der so empfindlich auf das Ausgangsmaterial reagiert, ist natürlich für die Industrie nur schwer einsetzbar", sagt Prof. Jörg Pietruszka, Leiter des Instituts für Bioorganische Chemie (IBG-1: Biotechnologie) der Heinrich-Heine-Universität Düsseldorf auf dem Campus des Forschungszentrums Jülich. "Deshalb wollten wir genauer untersuchen, was die Ursache der mangelnden Stabilität ist."
Gemeinsam mit Strukturbiologen des Jülicher Institute of Complex Systems: Strukturbiochemie (ICS-6) und des Düsseldorfer Instituts für Physikalische Biologie nutzten die Forscher eine Kombination extrem hochauflösender Verfahren, um die Reaktionsschritte mit molekularer Präzision zu beobachten. Die bisherige Vermutung, dass Acetaldehyd als recht aggressiver Stoff die empfindliche Proteinstruktur zerstöre, bestätigte sich dabei nicht. Stattdessen offenbarten die eingesetzten Verfahren NMR-Spektroskopie und Röntgenstrukturanalyse ein seltenes Nebenprodukt der Reaktion als tatsächliche Ursache. Sogenanntes Crotonaldehyd, ein kleines Molekül aus nur wenigen Atomen, blockierte im aktiven Zentrum des Enzyms eine für die Katalyse entscheidende Stelle. Der Effekt tritt erst bei höheren Konzentrationen von Acetaldehyd auf, weil Crotonaldehyd erst unter diesen Bedingungen in hinreichender Menge gebildet wird.
"Der Einblick in die molekularen Abläufe legte zudem eine einfache Möglichkeit nah, um das Problem abzustellen", erklärt Markus Dick, Erstautor der Studie. Indem die Forscher eine Aminosäure im Bauplan des Enzyms austauschten, konnten sie eine Version des Enzyms herstellen, die vollständig resistent gegen die Acetaldehyd-Bremse ist. Die Hoffnungen, die von Seiten der Industrie in DERA gesetzt werden, könnten sich dadurch nun erfüllen.
Prof. Dieter Willbold, Leiter des Biomolekularen Zentrums und Direktor des Düsseldorfer Instituts für Physikalische Biologie und des Jülicher ICS-6 dazu: "Für die Optimierung biotechnologischer Prozesse könnte diese strukturbasierte Vorgehensweise Schule machen."
Originalveröffentlichung
Markus Dick, Rudolf Hartmann, Oliver H. Weiergräber, Carolin Bisterfeld, Thomas Classen, Melanie Schwarten, Philipp Neudecker, Dieter Willbold and Jörg Pietruszka; "Mechanism-based inhibition of an aldolase at high concentrations of its natural substrate acetaldehyde: structural insights and protective strategies"; Chem. Sci.; 2016, 7 (July), 4492-4502




















































