Ein Protein als Vorbild moderner Mess- und Regeltechnik
Robuste Regelung des Kalium-Haushalts von Bakterien durch Protein-Doppelsensor
Moderne Heizungen verwenden einen Innen- und einen Außensensor, um energiesparend wohnliche Temperaturen zu erreichen. Genau eine solche Doppelsensor-Strategie haben Wissenschaftler der Technischen Universität München (TUM) und der Ludwig-Maximilians-Universität München (LMU) nun bei einem Protein des Darmbakteriums Escherichia coli entdeckt.
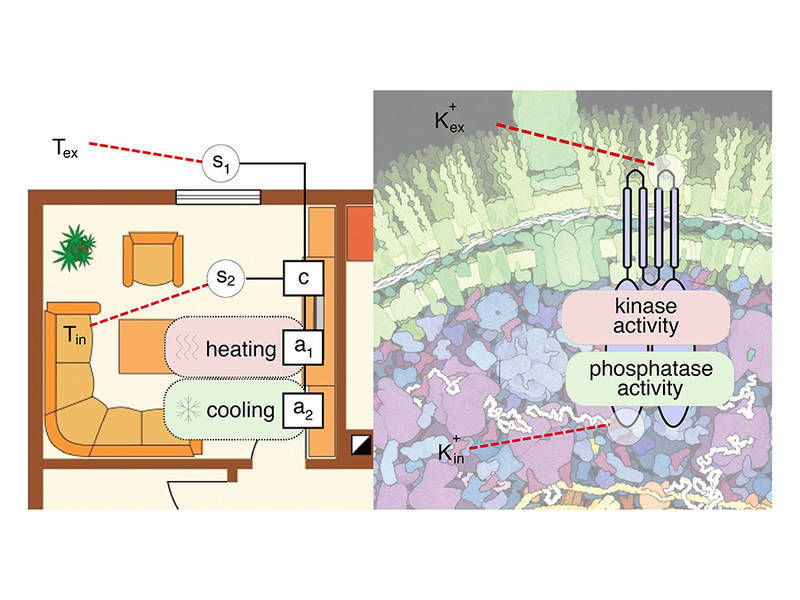
Mit einer robusten Doppelstrategie regelt das Bakterium E. coli seinen Kaliumhaushalt. Ganz ähnliche Strategien gibt es in der modernen Mess- und Regeltechnik
Filipe Tostevin / TUM, David Goodsell / PDB-101
Kalium ist entscheidend für viele Funktionen biologischer Zellen. Eine präzise Steuerung des Kaliumhaushalts ist daher lebenswichtig. Bakterien, wie zum Beispiel Escherichia coli, stehen dabei vor dem Problem, dass die Kaliumkonzentration in der Umgebung oft hundertmal geringer ist als in der Zelle und stark schwankt. Auch der Kaliumbedarf der Zelle selbst variiert.
In Zusammenarbeit mit Physikern um Professor Ulrich Gerland, Inhaber des Lehrstuhls für Theorie komplexer Biosysteme der TU München, haben Biologen der LMU um Professor Kirsten Jung die Mechanismen aufgeklärt, mit denen das Sensorprotein KdpD die optimale Kaliumversorgung der Zelle sicherstellt. Entscheidend ist dabei: Der Sensor misst die Kaliumkonzentration sowohl innerhalb als auch außerhalb der Zelle.
Mit dieser dualen Strategie, die besonders bei wechselnden Umweltbedingungen vorteilhaft ist, sorgt das Sensorprotein KdpD für eine optimale Kaliumversorgung: Ist die Kaliumkonzentration in der Umgebung niedrig, wirkt KdpD als sogenannte Kinase und überträgt eine Phosphatgruppe auf ein Regulatorprotein im Zellinneren – was wiederum die Bildung eines Transportermoleküls (KdpFABC) initiiert, das Kalium in die Zelle befördert.
Hat die Zelle keinen zusätzlichen Bedarf, weil die Kaliumkonzentration genügend hoch ist, wirkt KdpD als sogenannte Phosphatase, die die Aktion der Kinase rückgängig macht, indem sie die vorher übertragene Phosphatgruppe wieder entfernt. Damit wird die Produktion des Transportermoleküls gestoppt.
Duale Sensorik
Das Enzym setzt dabei eine duale Strategie ein: KdpD reicht als sogenannter Transmembran-Rezeptor durch die Zellmembran hindurch und besitzt zwei Erkennungsregionen für Kalium, eine von außen zugängliche und eine innerhalb der Zelle. Bindet Kalium an die externe Erkennungsstelle, wird die Kinaseaktivität herunter geregelt. Bindet Kalium dagegen an die interne Bindungsstelle, wird die Phosphataseaktivität aktiviert.
„Die Zelle kann damit sowohl bei niedrigen Kaliumkonzentrationen in der Umgebung als auch bei einem erhöhten zellulären Bedarf die Produktion des Kaliumtransporters anschalten – und zwar durch eine Feinjustierung des Verhältnisses von Kinase- und Phosphataseaktivität. Dies ermöglicht auch unter fluktuierenden Bedingungen eine sehr präzise Steuerung des Kaliumgehalts in der Zelle“, sagt Jung.
„Wir waren völlig überrascht darüber, dass die Natur eine solche Doppelstrategie in nur einem Protein realisiert hat“, sagt Prof. Ulrich Gerland. „Wir vermuten, dass die Integration aller Funktionen in einem Protein nicht nur eine präzisere Reglung ermöglicht, sondern die Regelung auch robuster macht. Denn so funktioniert die Regelung auch dann sicher, wenn die Anzahl der Regelproteine zeitlich schwankt.“
Die Wissenschaftler sind überzeugt, dass auch andere an der Steuerung wichtiger Prozesse beteiligte Rezeptoren bisher unerkannte duale Sensoren sind und wollen nun weitere Rezeptoren hinsichtlich dieser Eigenschaft untersuchen.