Roquin erkennt neu entdecktes RNA-Motiv in Genen
Wissenschaftler des Helmholtz Zentrums München haben eine bisher unbekannte Haarnadelstruktur in der Boten-RNA (mRNA) von immunologisch relevanten Genen identifiziert, die das Bindeprotein Roquin mit einer ähnlich hohen Affinität wie das bisher bekannte Abbauelements CDE (constitutive decay element) erkennt. Beide Haarnadelstrukturen sind physiologisch bedeutsam, da sie im Roquin-induzierten mRNA-Abbau zusammenarbeiten.
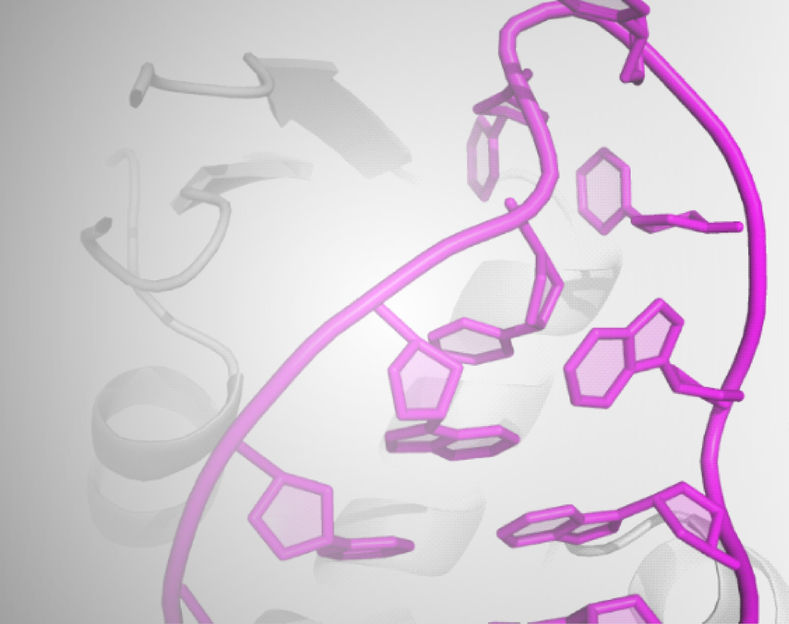
Ausschnitt aus der Kristallstruktur der Roquin ROQ-Domäne (grau, im Hintergrund angedeutet) im Komplex mit der neu identifizierten Hexa-loop RNA-Haarnadel
Helmholtz Zentrum München
Roquin spielt eine Schlüsselrolle bei der Aktivierung und Differenzierung von T-Zellen. Durch sein regulierendes Eingreifen in die Expression von Proteinen ist Roquin von zentraler Bedeutung für die immunologische Toleranz des Körpers. „Die Aufklärung der Ziel-mRNA und deren Erkennung stellt die Basis im Verständnis der Roquinfunktion dar, die zukünftige pharmakologische Modulationen ermöglichen wird“, sagt Prof. Dr. Michael Sattler, Direktor des Instituts für Strukturbiologie (STB) am Helmholtz Zentrum München.
Struktur und Funktion neuer regulatorischer Motive in der Boten-RNA
Während die Transkription im Zellkern auf dem Erkennen von Sequenzen in der DNA beruht, setzt die posttranskriptionale Genregulation im Zytoplasma durch RNA-Bindeproteine an der Bindung von Sekundärstruktur und Sequenz der RNA an. Daraus resultieren dynamische und hochkomplexe Regulationsmechanismen, die eine zentrale Bedeutung bei der Entstehung von physiologischen und pathologischen Immunreaktionen besitzen.
Das Verständnis dieser molekularen Vorgänge sind die Grundlagen, um die pathologischen Immunreaktionen besser zu verstehen. „Die Identifizierung unterschiedlicher Sequenzmotive in mRNAs, die von Roquin gebunden werden, ermöglicht uns jetzt herauszufinden, wie diese verschiedenen Strukturen in größeren cis-regulatorischen Sequenzen in den von Roquin kontrollierten RNA-Molekülen zusammenarbeiten“, so Prof. Dr. Vigo Heissmeyer, Leiter der Abteilung Molekulare Immunregulation (AMIR) am Helmholtz Zentrum München.
Überraschenderweise zeigten die Untersuchungen, dass nicht nur ein bisher bekanntes RNA-Haarnadelmotiv mit drei ungepaarten Basen, sondern auch ein neuartiges Motiv bestehend aus einer Schleife mit sechs ungepaarten Basen, von Roquin erkannt wird. „Die strukturelle Aufklärung der zugrundeliegenden Proteine ist hier ein wichtiger Ansatz, um die molekularen Grundlagen immunologischer Prozesse im Detail zu verstehen, und kann in Zukunft neue Wege für eine gezielte Therapie von Immunerkrankungen eröffnen,“ ergänzt Prof. Dr. Dierk Niessing, Leiter der Arbeitsgruppe RNA-Biologie am Institut für Strukturbiologie.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte

Klebstoffe aus Restholz, Biosprit aus Stroh - EU-Forschungsprojekt zu den Potenzialen von Agrar- und Forstabfällen als umweltfreundliche Rohstoffe abgeschlossen
Selbsttoleranz

Handynutzung erhöht nicht das Risiko von Hirntumoren

Eine echte Alternative zum Erdöl - Synthese biobasierter Hochleistungs-Polyamide aus biogenen Reststoffen




















































