Biosensor misst Signalmoleküle in Zilien
Wissenschaftler können die Dynamik von Signalmolekülen nun auch in kleinsten Zellbereichen untersuchen
Wissenschaftler des Bonner Forschungszentrums caesar, einem Institut der Max-Planck-Gesellschaft, haben einen Biosensor entwickelt, der selbst minimale Konzentrationsänderungen des Signalmoleküls cAMP in Zellen messen kann. Der Sensor erlaubt es, cAMP-gesteuerte Signalwege auch in kleinsten Bereichen der Zelle, beispielsweise in Zilien und Flagellen, zu untersuchen. Die Wissenschaftler der Minerva Max-Planck-Forschungsgruppe „Molekulare Physiologie“ um Dagmar Wachten und der Abteilung „Molekulare Neurosensorik“ um Benjamin Kaupp konnten mithilfe des Sensors herausfinden, wie die cAMP-Produktion im Flagellum von Mausspermien reguliert wird.
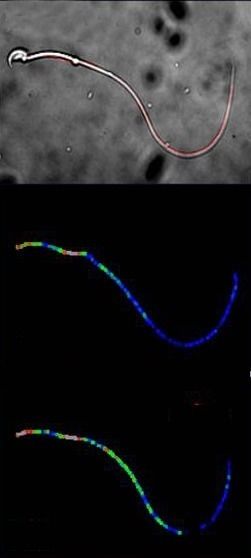
Lichtmikroskopische Aufnahme eines Mausspermiums (oben) mit Flagellum (rot). Die Änderungen der cAMP-Konzentration unterscheiden sich in verschiedenen Bereichen des Flagellums deutlich: Mittleres Bild: normale, unteres Bild erhöhte cAMP-Konzentration (blau entspricht einer niedrigen und rot einer hohen Konzentration).
© Forschungszentrum caesar
Zellen vermessen ständig ihre Umgebung. Sie verarbeiten die Informationen und ändern daraufhin ihr Verhalten – sie wachsen, bewegen sich oder ändern ihre Struktur. Die Information über die Umgebung wird an der Oberfläche der Zelle aufgenommen und durch Signalmoleküle, sogenannte sekundäre Botenstoffe, in das Zellinnere übertragen. Einer der bekanntesten sekundären Botenstoffe ist cAMP, der bei vielen biochemischen Signalwegen eine wichtige Rolle spielt.
Um Information in ihrer Umwelt zu erkennen, nutzen viele Zellen haarähnliche Strukturen auf ihrer Oberfläche – sogenannte Zilien oder Flagellen. Manche Zilien können sich bewegen, andere sind starr. Ein Spezialfall eines beweglichen Ziliums ist das Flagellum mit seinem wohl bekanntesten Beispiel, dem Spermienschwanz. Die Bewegung solcher beweglichen Zilien wird häufig durch cAMP gesteuert.
Bislang war es für Wissenschaftler schwierig, Änderungen der cAMP-Konzentration in den Zilien zu untersuchen. Sie benötigten dazu fluoreszierende Biosensoren, die sich jedoch nur mühsam in diese oft winzigen Bereiche der Zelle einbringen lassen und zudem nicht empfindlich genug sind, um sehr geringe cAMP-Konzentrationen zu messen.
Das Forscherteam stellt nun einen neuen cAMP-Biosensor vor, der auf der sogenannten FRET-Technik (Förster resonance energy transfer) beruht. Mit FRET können Forscher den Energietransfer zwischen zwei lichtempfindlichen Molekülen messen. Im neuen cAMP-Biosensor hängt die Energieübertragung vom Abstand und der Orientierung zweier lichtempfindlicher Moleküle ab. Nach der Bindung von cAMP vergrößert sich der Abstand der beiden Moleküle; damit verringert sich die übertragbare Energie.
Der von den caesar-Wissenschaftlern entwickelte Biosensor reagiert bereits auf minimale Konzentrationsänderungen des Signalmoleküls cAMP. Die Forscher testeten den Sensor im Flagellum von Mausspermien und konnten untersuchen, wie dort die cAMP-Produktion reguliert wird. Interessant ist hierbei vor allem, dass sich die cAMP-Dynamik in unterschiedlichen Bereichen des Flagellums deutlich unterscheidet.
In der Zukunft soll der neue Biosensor auch in anderen Strukturen und Zellbereichen eingesetzt werden, um cAMP-gesteuerte Signalwege besser zu verstehen.
Originalveröffentlichung
Mukherjee, S., Jansen, V., Jikeli ,J. F., Hamzeh, H., Alvarez, L., Dombrowski, M., Balbach, M., Strünker, T., Seifert, R., Kaupp U. B. & Wachten, D.; "A novel biosensor to study cAMP dynamics in cilia and flagella"; eLife, 2016