Alzheimer: Neues stark neurotoxisches Peptid entdeckt
Wissenschaftler der Universitäten Bonn, Ulm und Göttingen haben im Gehirn von Alzheimer-Patienten ein neues Peptid entdeckt, das auf Nervenzellen stark giftig wirkt. Es scheint vor allem in sehr frühen Stadien der Erkrankung gebildet zu werden. Möglicherweise eröffnet der Fund mittelfristig neue diagnostische und therapeutische Möglichkeiten.
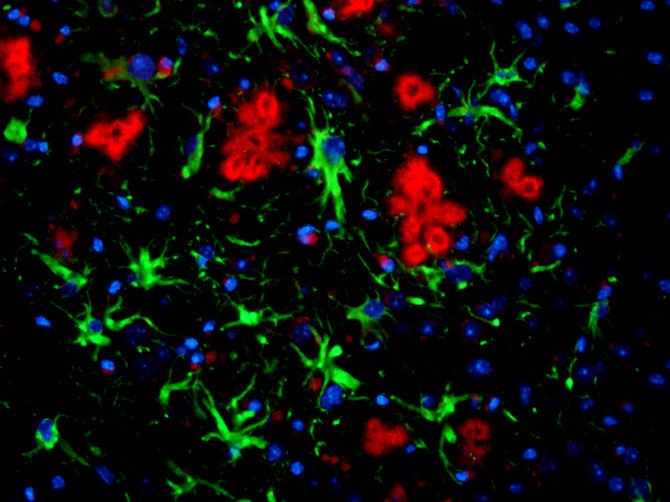
Das Foto zeigt einen gefärbten Dünnschnitt eines Mausgehirns: ß-Amyloid Peptid (rot), Astrozyten (grün) und die Kerne der Nervenzellen (blau).
© Foto: Abteilung für Neurologie/Universität Bonn
Im Gehirn von Alzheimer-Patienten finden sich regelmäßig massive Ablagerungen des Peptids ß-Amyloid. Die Protein-Fragmente lagern sich außerhalb der Nervenzellen zu langen fädigen Strukturen zusammen. Diese Amyloid-Knäuel werden im Hirngewebe als so genannte Plaques sichtbar. Sie sind für die Krankheit charakteristisch.
Früher ging man davon aus, dass die Plaques wesentlich für die Symptome der Demenzerkrankung verantwortlich sind. Neue Forschungsergebnisse liefern jedoch ein anderes Bild: Demnach sind die langen Fäden aus vielen hundert ß-Amyloid-Molekülen und die Plaques selbst für das Gehirn weniger schädlich. Wenn sich allerdings nur wenige ß-Amyloid-Moleküle als so genanntes Oligomer stabil zusammenlagern, wird es dagegen kritisch: Diese Oligomere verursachen eine weitaus größere funktionelle Störung von Nervenzellen.
Glücklicherweise sind Amyloid-Oligomere kurzlebig: Sie verschmelzen normalerweise schnell zu den vergleichsweise harmlosen Fäden. Die Wissenschaftler aus Bonn, Ulm und Göttingen haben aber nun eine Variante von ß-Amyloid entdeckt, die sich weniger gesellig zeigt: Aufgrund einer kleinen chemischen Änderung lagert diese Variante sich zwar zu Oligomeren zusammen. Sie bildet aber keine langen Fäden. „Die von uns entdeckte Variante ist daher für Nervenzellen extrem gefährlich“, erklärt Dr. Sathish Kumar, Erstautor der Studie.
Hoffnung auf bessere Diagnose
Das veränderte ß-Amyloid findet sich sowohl in Mäusen mit einer Alzheimer-ähnlichen Erkrankung als auch in Alzheimer-Patienten. In den Alzheimer-Plaques ist es allerdings kaum nachzuweisen. Stattdessen bildet es in den Nervenzellen selbst kleinere Ablagerungen. Dabei tritt es auch in sehr frühen Phasen der Erkrankung auf. Möglicherweise eignet es sich daher für eine bessere Früherkennung.
Langfristig eröffnet die Entdeckung eventuell auch neue therapeutische Optionen. So ist es beispielsweise denkbar, die gefährliche ß-Amyloid-Variante gezielt durch Antikörper auszuschalten und so zu inaktivieren. Prof. Dr. Jochen Walter von der Abteilung für Neurologie der Universität Bonn warnt aber vor überzogenen Hoffnungen: „Wir wissen bislang noch nicht einmal, wie wichtig dieses veränderte Peptid für die Entstehung der Alzheimer-Demenz ist. Das ist eine ganz zentrale Frage, der wir nun in Folgestudien nachgehen wollen.“
Originalveröffentlichung
Sathish Kumar, Oliver Wirths, Kathrin Stüber, Patrick Wunderlich, Philipp Koch, Sandra Theil, Nasrollah Rezaei-Ghaleh, Markus Zweckstetter, Thomas A. Bayer, Oliver Brüstle, Dietmar R. Thal, Jochen Walter; "Phosphorylation of the amyloid ß-peptide at Ser26 stabilizes oligomeric assembly and increases neurotoxicity"; Acta Neuropathologica
Meistgelesene News
Originalveröffentlichung
Sathish Kumar, Oliver Wirths, Kathrin Stüber, Patrick Wunderlich, Philipp Koch, Sandra Theil, Nasrollah Rezaei-Ghaleh, Markus Zweckstetter, Thomas A. Bayer, Oliver Brüstle, Dietmar R. Thal, Jochen Walter; "Phosphorylation of the amyloid ß-peptide at Ser26 stabilizes oligomeric assembly and increases neurotoxicity"; Acta Neuropathologica
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.