Auf Mutationen ausgerichtete T-Zellen gehen gegen Tumoren vor
Eine vielversprechende Strategie für zukünftige Krebstherapien: Immunzellen so zu modifizieren, dass sie Tumoren erkennen und abtöten. Anders als unspezifische Formen der T-Zell-Therapie verspricht die Ausrichtung auf Mutationen von Krebszellen, weniger Nebenwirkungen zu verursachen. In vorklinischen Tests in Mäusen bewies dieser neue Ansatz nun sein Potenzial.
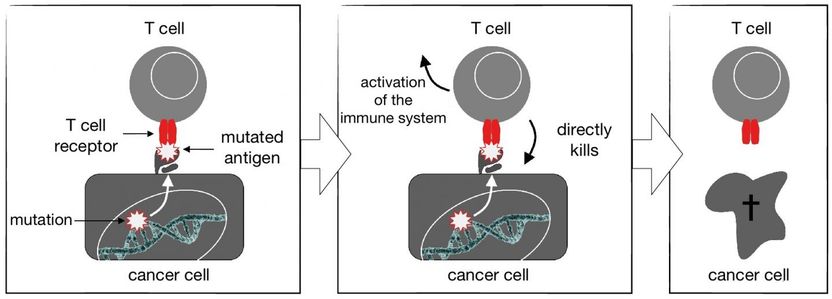
Die T-Zelle zerstört eine Körperzelle mit einem mutierten Antigen.
Matthias Leisegang
Ein internationales Forscherteam mit Wissenschaftlern des Max-Delbrück-Centrums für Molekulare Medizin (MDC), der Charité, des Berliner Instituts für Gesundheitsforschung (BIG), der Humboldt-Universität und der Universität von Chicago hat Zellen des Immunsystems so verändert, dass sie Tumorzellen erkennen und gezielt bekämpfen. Wie dies funktioniert, demonstrierten die Wissenschaftler erfolgreich in Mäusen. Auf den Erkenntnissen aufbauende Krebstherapien hätten weniger Nebenwirkungen als derzeit übliche Methoden.
Das Immunsystem ist die schlagkräftigste Waffe gegen Krankheiten, daher ist die Aktivierung der Selbstheilungskräfte im Kampf gegen Krebs so vielversprechend. Die Berliner Wissenschaftlerteams um Wolfgang Uckert, Thomas Blankenstein und Matthias Leisegang verfolgen zusammen mit dem US-Forscher Hans Schreiber die Idee, T-Zellen gezielt auf mutierte Proteine in Krebszellen auszurichten.
T-Zellen sind eine Art mobiles Einsatzkommando des Immunsystems, das im Körper patrouilliert und mit T-Zell-Rezeptoren die Oberfläche von Körperzellen nach Protein-Fragmenten (Antigenen) abtastet. Die Antigene stammen aus dem Inneren der Körperzellen. Wird eines dieser Protein-Bruchstücke als „körperfremd“ erkannt, wird die Zelle getötet. Auch die abnormen Proteine, die in Krebszellen durch Genmutation entstehen, können T-Zellen als „fremd“ erkennen.
Bei der Entstehung eines Tumors scheint der Abwehrmechanismus nicht zu greifen: T-Zellen wandern zwar in den Tumor ein und erkennen dessen Antigene, sind aber inaktiv. Sie lassen sich kaum therapeutisch nutzen, erklärt Matthias Leisegang, aber „die tumorspezifischen T-Zell-Rezeptoren kann man in frische T-Zellen verpflanzen, die man aus dem Blut des Patienten gewinnt. Diese Verpflanzung erfolgt mit genetisch veränderten Viren, die ihr Erbmaterial in Millionen von T-Zellen einbauen können. Anschließend gibt man diese Zellen dem Patienten zurück.“ Dort bekämpfen die T-Zellen dann den Tumor.
Diese Gentherapie mit T-Zell-Rezeptoren testete das Wissenschaftlerteam um Hans Schreiber in einem realistischen, klinisch relevanten Szenario. „Wir haben den therapeutischen Ansatz in der Maus nachempfunden“, sagt Leisegang. Hans Schreibers Team an der Universität von Chicago analysierte die Gene eines Tumors aus der Maus und identifizierte eine Mutation, die in allen Regionen des Tumors auftrat und auch als Antigen den Weg an die Oberfläche fand. T-Zellen der Maus wurden mit einem mutationsspezifischen T-Zell-Rezeptor bewaffnet und dem Tier verabreicht. So wurde der Tumor fast vollständig zurückgedrängt. Klinisch relevant: kombiniert mit einer lokalen Bestrahlung des Tumors wurde eine vollständige Remission erreicht. Die Ergebnisse der Studie erschienen im Fachblatt Clinical Cancer Research.
In einer Publikation zeigen die Berliner Forscher, wie wichtig tierexperimentelle Vorversuche sind, damit eine mutationsspezifische Therapie letztlich erfolgreich ist. So erscheinen manche Mutationen im Zellkulturversuch als geeignetes Ziel einer Therapie, können dieses Versprechen jedoch im Körper des Patienten nicht halten. Mit einem Mausmodell, das an entscheidenden Stellen menschliche Moleküle für die Antigen-Erkennung trägt, ist es den Teams um Thomas Blankenstein und Wolfgang Uckert gelungen, „gute“ von „schlechten“ Antigenen klar zu unterscheiden. „Wir haben ein Tiermodell entwickelt, mit dem T-Zell-Rezeptoren und Antigene auf ihre therapeutische Eignung untersucht werden können – eine wichtige Voraussetzung, um eine klinische Anwendung vorzubereiten“ stellt Leisegang fest.
Auch wenn er und seine Kollegen erfolgreich Immunzellen für die Krebsbekämpfung trainiert haben, eine fertige Therapie sei das noch nicht, betont Leisegang. Ähnliche Verfahren würden derzeit klinisch erprobt, allerdings nur mit Antigenen ohne Mutationen: die T-Zellen greifen deshalb unter Umständen auch gesundes Gewebe an. Der Einsatz mutationsspezifischer T-Zell-Rezeptoren ist gezielter und würde weniger Nebenwirkungen verursachen. Die Methode ist aber auch viel aufwendiger, da sie für jeden Patienten individuell angepasst werden muss. Zusammen mit weiteren Gruppen des MDC und der Charité arbeiten die Forscher nun an der klinischen Umsetzung und werden dabei vom BIG unterstützt.
Originalveröffentlichung
Matthias Leisegang, Boris Engels, Karin Schreiber, Poh Yin Yew, Kazuma Kiyotani, Christian Idel, Ainhoa Arina, Jaikumar Duraiswamy, Ralph R. Weichselbaum, Wolfgang Uckert, Yusuke Nakamura and Hans Schreiber; "Eradication of large solid tumors by gene therapy with a T cell receptor targeting a single cancer- specific point mutation"; Clinical Cancer Research; 2015
Matthias Leisegang, Thomas Kammertoens, Wolfgang Uckert and Thomas Blankenstein; "Targeting human melanoma neoantigens by T cell receptor gene therapy."; Journal of Clinical Investigation; 2016
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Gentherapie
Genetische Erkrankungen, die einst als unbehandelbar galten, stehen nun im Zentrum innovativer therapeutischer Ansätze. Die Forschung und Entwicklung von Gentherapien in Biotech und Pharma zielen darauf ab, defekte oder fehlende Gene direkt zu korrigieren oder zu ersetzen, um Krankheiten auf molekularer Ebene zu bekämpfen. Dieser revolutionäre Ansatz verspricht nicht nur die Behandlung von Symptomen, sondern die Beseitigung der Krankheitsursache selbst.

Themenwelt Gentherapie
Genetische Erkrankungen, die einst als unbehandelbar galten, stehen nun im Zentrum innovativer therapeutischer Ansätze. Die Forschung und Entwicklung von Gentherapien in Biotech und Pharma zielen darauf ab, defekte oder fehlende Gene direkt zu korrigieren oder zu ersetzen, um Krankheiten auf molekularer Ebene zu bekämpfen. Dieser revolutionäre Ansatz verspricht nicht nur die Behandlung von Symptomen, sondern die Beseitigung der Krankheitsursache selbst.