Tarnkappen-Effekt bei Nanocarriern als Medikamenten-Transporter künftig noch besser nutzbar
Wissenschaftler der Universitätsmedizin Mainz und des Max-Planck-Instituts für Polymerforschung (MPI-P) entschlüsseln Stealth-Effekt von Nanocarriern gegen Fresszellen des Immunsystems.
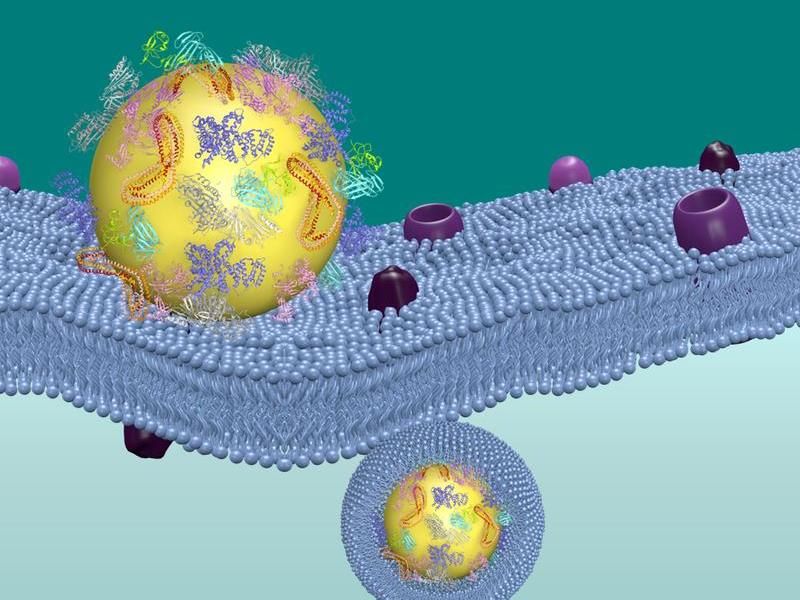
Nanocarrier (gelb) werden von komplexen Mischungen aus Proteinen bedeckt, bevor sie mit Zellmembranen interagieren und dann aufgenommen werden.
MPI-P
Mithilfe von „Medikamenten-Transportern“, sogenannten Nanocarriern, gelangen Wirkstoffe an erkrankte Stellen im Körper. Dort forcieren sie den Heilungsprozess. Damit die Fresszellen des Immunsystems sie aber nicht vor Erreichen des Wirkortes aufspüren, sind die Nanocarrier-Oberflächen mit dem biokompatiblen Polymer Polyethylenglykol (PEG) versehen. Dieses rekrutiert bestimmte Proteine aus dem Blutplasma und bildet dadurch eine Art Tarnkappe auf den Nanocarriern. Deshalb heißt das Prinzip auch Tarnkappen-Effekt oder Stealth-Effekt. Wissenschaftler der Universitätsmedizin Mainz und des MPI-P fanden nun heraus, welche speziellen Proteine an das PEG anhaften müssen. Auf Basis dieser Entdeckung lassen sich Nanocarrier als Medikamenten-Transporter besser vor den Fresszellen des Immunsystems verbergen. Die Wissenschaftler haben diese Erkenntnis bereits auf andere Polymere, sogenannte Polyphosphate, übertragen. Diese sind im Vergleich zu PEG biologisch abbaubar und daher hoffnungsvolle Kandidaten für Wirkstoffträger in der langfristigen Therapie von chronischen Krankheiten.
Proteinbeladung bestimmt Stealth-Effekt
Die Eigenschaft von PEG, Nanocarrier und andere Substanzen länger im Blut zirkulieren zu lassen, ist in der Medizin bereits bekannt. Allerdings wurde sie bisher damit erklärt, dass PEG eine Verminderung der Gesamtproteinbelegung der Nanocarrier-Oberfläche bewirkt. Die Arbeit von Dr. Frederik Wurm und Prof. Dr. Katharina Landfester vom MPI-P und von Univ.-Prof. Dr. Volker Mailänder von der Universitätsmedizin Mainz führt in dieser Art der Oberflächenmodifikation allerdings einen Paradigmenwechsel herbei: Zusammen mit ihren Kollegen konnten die Forscher zeigen, dass nicht die Verminderung einer Proteinanhaftung wesentlich für den Stealth-Effekt ist, sondern die zusätzliche Anreicherung von bestimmten Proteinen. So stellt nicht PEG selbst die Tarnkappe dar, sondern die Anhaftung von spezifischen Proteinen aus dem Blutplasma, allen voran das Apolipoprotein J, auch Clusterin genannt. Durch die selektive Adsorption des Clusterins wird die Tarnung der Nanocarrier erst ermöglicht, damit sie an ihrem jeweiligen Zielort im Körper ankommen.
Dies fanden die Ärzte und Biowissenschaftler heraus, indem sie verschiedene Nanocarrier veränderten und vergleichende Studien mit den anhaftenden Proteinen durchführten. „Mithilfe der hochauflösenden Massenspektrometrie konnten wir aus dem komplexen Gemisch des Blutplasmas genau analysieren, welche Proteine auf den Nanocarriern haften bleiben und wie sich diese zusammensetzen“, erklärt Mailänder. „Durch diese Erkenntnisse gelang es uns ebenfalls, eine neue Substanzklasse als Alternative zu PEG zu etablieren: Polyphosphat lässt sich vollständig biologisch abbauen, während das derzeit verwendete PEG bei einer Langzeitabgabe im Körper akkumulieren und Unverträglichkeiten hervorrufen kann“, ergänzt Wurm. „Dieses Ergebnis eröffnet auch die Möglichkeit, vollständig auf künstliche Materialien zu verzichten und für den Stealth-Effekt natürlich vorkommende Proteine zu nutzen“. Landfester fügt hinzu: „Mainz bietet für ein solches Forschungsprojekt einen einzigartigen Standort, weil es polymere Synthese, Kolloidchemie und Biomedizin kombiniert und somit eine ideale Ausgangsituation darstellt“. „Nanocarrier spielen in der therapeutischen Anwendung eine wichtige Rolle. Die neuen Erkenntnisse von Dr. Mailänder und Dr. Wurm auf diesem Forschungsfeld haben Meilensteincharakter“, so der Wissenschaftliche Vorstand der Universitätsmedizin Mainz, Univ.-Prof. Dr. Ulrich Förstermann.
Wirkstoffe gelangen effizient ans Ziel
Diese Erkenntnisse werden die Entwicklung neuer Medikamente zur Bekämpfung von erkranktem Gewebe, beispielsweise Tumoren, wesentlich beeinflussen. So kann damit beispielsweise die Gesamtdosis bei verlängerter Wirkzeit reduziert werden. Dies ist insbesondere für nebenwirkungsreiche chemotherapeutische Tumorbehandlungen entscheidend.