Neuer Signalweg bei entzündungsförderndem Protein entdeckt
Zytokine sind spezielle Proteine, die im Körper steuern, wie stark Zellen wachsen und in welche Zelltypen sie sich differenzieren. Fehlerhafte Programmierungen der Zytokine können beispielsweise Krebs erzeugen oder sie übersteuern entzündliche Reaktionen des Körpers. Eine Folge sind chronisch-entzündliche Erkrankungen. Ein Team des Exzellenzclusters Entzündungsforschung entdeckte jetzt einen bisher unbekannten Signalweg beim Interleukin-11, einem Botenstoff aus der Familie der Zytokine. Das Wissen über diesen Signalweg bietet die Möglichkeit, therapeutisch gegen bestimmte Erkrankungen vorzugehen.
Interleukin-11 ist eines der Zytokine, die im Körper Entzündungsreaktionen steuern.
Juliane Lokau, Uni Kiel
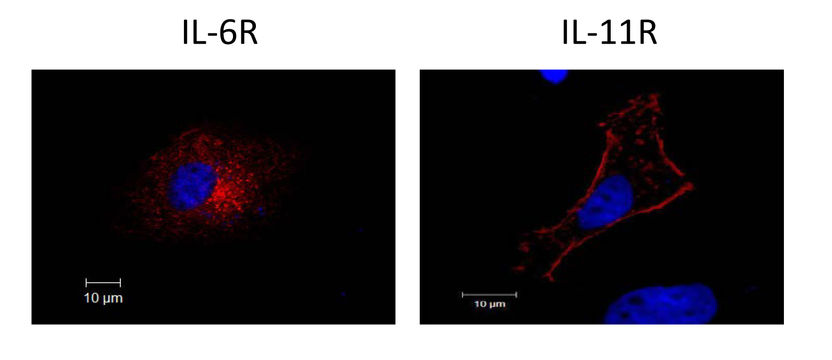
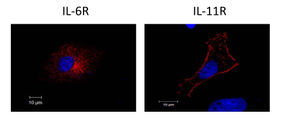
Fluoreszenzmikroskopische Aufnahme der Rezeptoren von Interleukin-6 (IL-6R) und Interleukin-11 (IL-11R). Während der IL-11R nach Aktivierung der Protease ADAM17 auf der Zelloberfläche verbleibt und an der Plasmamembran die ganze Zelle umrandet (rechtes Bild), ist der IL-6R vollständig von der Zelloberfläche verschwunden (linkes Bild). Blau: Zellkern.
Niloufar Monhasery, Uni Kiel
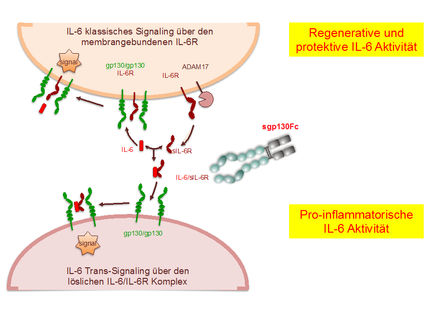
Bei chronisch-entzündlichen Erkrankungen ist der Gehalt bestimmter Zytokine im Körper stark erhöht. Bisher kannte man vor allem das Interleukin 6 (IL-6), dem in diesem Bereich eine Schlüsselfunktion zukommt. Dabei existieren zwei Möglichkeiten, wie die Interleukine Entzündungsreaktionen steuern können. Zum einen existieren an bestimmten Körperzellen Rezeptoren, die ein Signal der Proteine empfangen können und in der Folge beispielsweise bakterielle Entzündungen bekämpfen. Dies ist die direkte Form der Signalübermittlung, Fachleute bezeichnen diese als membrangebundene Signalübertragung. Eine zweite Form sind die sogenannten löslichen Rezeptoren, die an einer Vielzahl von Körperzellen existieren. Sie werden auch als „trans-signaling“ bezeichnet und können eine verstärkte Entzündungsreaktion verursachen.
Für das Interleukin 11 (IL-11) war bisher nur die membrangebundene Signalübertragung bekannt. Die neuen Ergebnisse der Kieler Forscherinnen und Forscher zeigen, dass auch bei diesem Protein die Signalübertragung über lösliche Rezeptoren funktioniert. Dr. Christoph Garbers, Leiter der Studie, betont die große Bedeutung dieser Entdeckung für therapeutische Ansätze: „Die Entdeckung des ‚trans-signaling‘ beim IL-11 eröffnet die Möglichkeit, an dieser Schaltstelle therapeutisch einzugreifen.“ In klinischen Studien wird zurzeit eine Substanz getestet, die beim Menschen gezielt die überschießende und dadurch negative Aktivität des IL-6 hemmt. Das funktioniert, weil das synthetische Protein nur das „trans-signaling“ blockiert, nicht aber das normale „signaling“. Daher ist diese Substanz sehr vielversprechend, weil sie den membrangebundenen Rezeptor „in Ruhe lässt“. Möglicherweise könnte diese Substanz auch den übermäßigen Gehalt an IL-11 wirkungsvoll senken. Garbers: „Wir wollen als nächstes Krankheiten identifizieren, bei denen das IL-11 ‚trans-signaling‘ eine entscheidende Rolle spielt. Auf diese Weise könnten wir sehr gezielt in den hochkomplexen Zytokinhaushalt eingreifen, um nur den negativen Effekt bestimmter Botenstoffe zu reduzieren.“
Originalveröffentlichung
Juliane Lokau, Rebecca Nitz, Maria Agthe, Niloufar Monhasery, Samadhi Aparicio-Siegmund, Neele Schumacher, Janina Wolf, Katja Möller-Hackbarth, Georg H. Waetzig, Joachim Grötzinger, Gerhard Müller-Newen, Stefan Rose-John, Jürgen Scheller und Christoph Garbers; "Proteolytic cleavage governs Interleukin-11 trans-signaling"; Cell Reports; 2016