Parkinson: Neue Erkenntnisse über ein reisendes Protein
„Alpha-Synuclein“, ein für die Parkinson-Erkrankung wichtiges Protein, verhält sich nicht wie ein Prion
Bei Patienten mit der Parkinson-Krankheit lagert sich das Protein „Alpha-Synuclein“ in den Nervenzellen ab und scheint sich über miteinander verbundene Hirnbereiche auszubreiten. Wie dies geschieht, ist weitgehend unbekannt. Einer Hypothese zufolge könnte sich alpha-Synuclein wie ein „Prion“ verhalten: Demnach wären pathologische, also abnorme Formen des Proteins in der Lage, die Gestalt von normalem Alpha-Synuclein zu verändern. Infolgedessen würde das Protein aggregieren und sich von Nervenzelle zu Nervenzelle ausbreiten. Für dieses Phänomen wird der englische Fachbegriff „Seeding“ verwendet. Neueste Untersuchungen des Deutschen Zentrums für Neurodegenerative Erkrankungen (DZNE) zeigen jedoch, dass Aggregation, Ausbreitung und krankhafte Veränderungen, die durch Alpha-Synuclein verursacht werden, nicht zwangsläufig ein solches „Seeding“ erfordern. Stattdessen können diese Phänomene durch eine Überproduktion von Alpha-Synuclein ausgelöst werden, in deren Folge einzelne Proteine oder kleinere Protein-Aggregate von Nervenzelle zu Nervenzelle gelangen. Ein Forscherteam um Professor Donato Di Monte berichtet darüber im Fachjournal „BRAIN“.
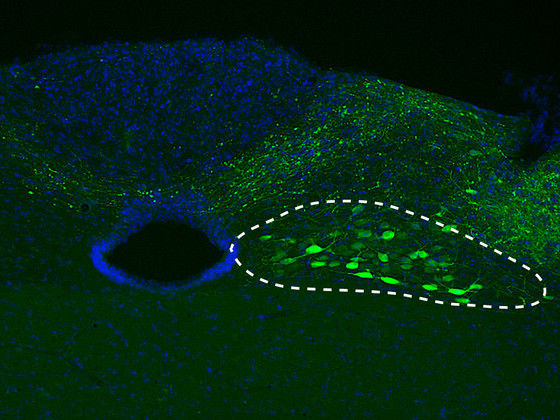
Für die aktuelle Studie schleusten DZNE-Forscher den Bauplan der menschlichen Variante von Alpha-Synuclein in die Nervenzellen (siehe gestrichelte Linie) von Mäusen.
DZNE/M. Helwig
Zahlreiche Belege unterstreichen, dass das Protein „Alpha-Synuclein“ für die Parkinson-Krankheit eine entscheidende Rolle spielt. So beobachtet man bei Mensch mit Parkinson, dass sich in ihren Gehirnen – und zwar innerhalb der Nervenzellen – nach und nach mikroskopisch kleine Ablagerungen ansammeln. Alpha-Synuclein ist ein Hauptbestandteil dieser zellulären Einschlüsse. Man nennt sie „Lewy-Körperchen“.
Oft beginnen die krankhaften Veränderungen in der „Medulla oblongata“, einer Region des Hirnstamms. Von dort breiten sie sich in Richtung Mittelhirn und Hirnrinde aus. Im Rahmen der aktuellen Studie, die zum Teil von der Paul Foundation gefördert wurde, ahmten die DZNE-Forscher dieses Phänomen in Mäusen nach. Mit Hilfe eines maßgeschneiderten Virus-Teilchens schleusten sie den Bauplan der menschlichen Variante von Alpha-Synuclein gezielt in Nervenzellen der Medulla oblongata der Mäuse. Diese Zellen stellten infolgedessen das fremde (menschliche) Alpha-Synuclein in relativ großem Umfang her und häuften es an.
Protein-Transport über weite Distanzen
Di Monte und seine Kollegen verfolgten über einen Zeitraum von sechs bis zwölf Wochen, wie sich das Protein im Mausgehirn verbreitete. Sie nutzten dafür spezielle Antikörper, die spezifisch menschliches Alpha-Synuclein erkennen, und verglichen auf diese Weise zwei Gruppen von Tieren miteinander: Alle Mäuse produzierten die per Virus-Teilchen eingebrachte, menschliche Variante von Alpha-Synuclein. Die Mäuse der einen Gruppe stellten zusätzlich eigenes, maustypisches – auch „endogen“ genanntes – Alpha-Synuclein her. Den anderen Mäusen fehlte aufgrund einer Erbgutveränderung das endogene Alpha-Synuclein, so dass sie nur die menschliche Version erzeugten.
Bei beiden Versuchsgruppen führte die Produktion des menschlichen Alpha-Synucleins dazu, dass es sich ausgehend von der Medulla oblongota allmählich in Richtung höher gelagerter (rostraler) Hirnbereiche verteilte. Die Ausbreitung folgte einem Muster, das auf eine Diffusion entlang anatomischer Verbindungen hindeutet. Das Protein überwand mindestens eine synaptische Anschlussstelle: nämlich den Übergang von der Medulla oblongota zum Pons, einem unmittelbar benachbarten Hirnbereich. Außerdem fanden die Forscher Hinweise dafür, dass Nervenzellen, die das Protein aufgenommen hatten, geschädigt waren.
Anders als Prionen
Ein „Seeding“-Mechanismus ähnlich dem von Prionen hätte zur Folge, dass sich Alpha-Synuclein leichter ausbreitet, falls abnorme Formen des Proteins und normale Formen miteinander wechselwirken. In den Mäusen ohne eigenes Protein gibt es jedoch kein Reservoir an möglichen Wechselwirkungspartnern. „Anders gesagt“, so Di Monte, „wir sind wir davon ausgegangen, dass sich das Protein in den Mäusen, die kein eigenes Alpha-Synuclein produzierten, weniger effektiv verbreiten würde. Und dass die Pathologie weniger ausgeprägt ist. Außerdem hatten wir erwartet, dass Ausbreitung und Pathologie mit einer Anhäufung von amyloidogenem Alpha-Synuclein einhergeht. Dabei handelt es sich um Proteinformen, die unlösliche, faserartige Aggregate bilden können.“
Im Gegensatz zu diesen Vorhersagen breitete sich das menschliche Alpha-Synuclein in den Mäusen ohne endogenes Protein stärker aus, als in den Tieren, die auch das eigene Protein produzierten. Die Abwesenheit des endogenen Proteins verstärkte gewissermaßen die Ausbreitung des fremden Alpha-Synucleins, statt sie – wie eigentlich erwartet – zu behindern. Zudem zeigte sich, dass von Nervenzelle zu Nervenzelle nur einzelne Proteine (sogenannte Monomere) oder kleinere Protein-Aggregate (sogenannte Oligomere) übertragen wurden. Jedoch keine größeren, faserartigen Aggregate. Dennoch kam es zu krankhaften Veränderungen.
„Diese Befunde geben wichtige Einblicke in die Krankheitsentwicklung“, sagt der Bonner Forscher. „Wenn sich Alpha-Synuclein über weite Distanzen ausbreitet, erfordert das nicht zwangsläufig die Erzeugung prion-artiger Proteinformen. Außerdem belegen unsere Daten, dass die simple Überproduktion des Proteins dessen Ausbreitung und pathologische Veränderungen verursachen kann.“ Die Studie zeige außerdem, so Di Monte weiter, dass sich Ausbreitung und Pathologie jedenfalls im Frühstadium der Erkrankung nicht auf der Grundlage faserartiger Aggregate entwickeln.
Weitere Studien geplant
Die Möglichkeit, dass sich Alpha-Synuclein möglicherweise wie ein Prion verhält, hat Anlass zu Spekulationen gegeben. Demnach könnte die Parkinson-Krankheit ähnlich wie einige Prionenerkrankungen (zum Beispiel die Creutzfeldt-Jakob-Krankheit) eventuell durch infektiöse Proteine hervorgerufen werden. Di Monte betont: „Es gibt absolut keinen Hinweis dafür, dass die Parkinson-Erkrankung eine ansteckende Krankheit sein könnte. Vielmehr zeigt unsere Untersuchung, dass entscheidende Aspekte der Parkinson-Erkrankung wie die Übertragung von Alpha-Synuclein von Nervenzelle zu Nervenzelle und die Protein-Aggregation durch Mechanismen erklärt werden können, die nicht prion-artig sind.“
Di Monte und seine DZNE-Kollegen beabsichtigen, das Protein Alpha-Synuclein weiter zu untersuchen. Insbesondere möchten sie herausfinden, ob es Ansatzpunkte bietet, den Verlauf der Parkinson-Erkrankung zu verlangsamen oder gar aufzuhalten.
Originalveröffentlichung
Michael Helwig, Michael Klinkenberg, Raffaella Rusconi, Ruth E. Musgrove, Nour K. Majbour, Omar M.A. El-Agnaf, Ayse Ulusoy and Donato A. Di Monte; „Brain propagation of transduced α-synuclein involves nonfibrillar protein species and is enhanced in α-synuclein null mice“; BRAIN


























































