Eileiter in der Petrischale
Max-Planck-Forscher züchten aus Stammzellen Schleimhaut menschlicher Eileiter
Modellsysteme helfen Wissenschaftlern die Funktionsweise von Zellen, Geweben oder Organen zu untersuchen. Für solche Labormodelle und ihre natürlichen Gegenstücke gilt dabei: Je ähnlicher desto besser. Forscher vom Max-Planck-Institut für Infektionsbiologie in Berlin haben nun die innerste Schicht des menschlichen Eileiters – eine Schleimhaut mit Falten und Furchen – im Labor wachsen lassen. Aus Stammzellen entwickelten sich nicht nur die Zelltypen, die in dieser Schleimhaut vorkommen, sondern auch Merkmale des ganzen Organs wie seine charakteristische Architektur. In ihrem Labormodell haben die Forscher zwei Signalwege entdeckt, die ausschlaggebend für ein konstantes Wachstum sind. Zusätzlich konnten sie indirekt zeigen, dass die Eileiterschleimhaut eigene Stammzellen besitzt, die zu einer ständigen Erneuerung führen. Aufgrund ihren Erkenntnissen und der Möglichkeit, den künstlichen Eileiter im Labor ausgiebig zu erforschen, möchten die Wissenschaftler etwa den Verlauf von Infektionen und die Entstehung von Eierstockkrebs besser verstehen.
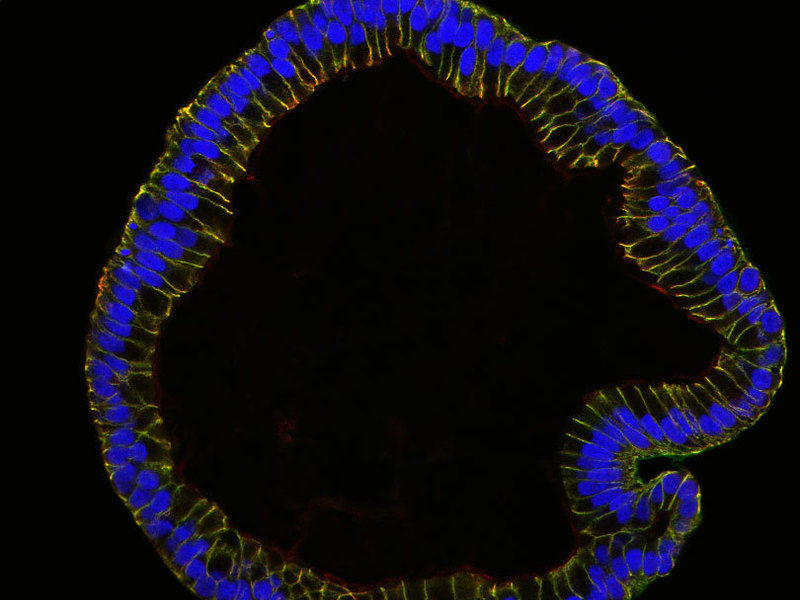
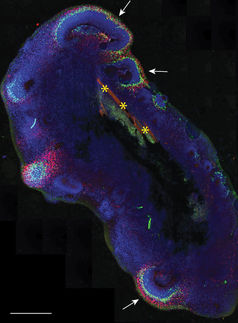
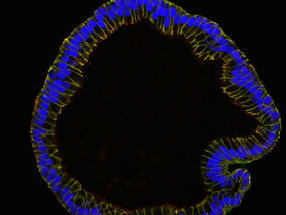
Mithilfe von Stammzellen in der Petrischale gezüchtetes Eileiter-Epithel.
© MPI f. Infektionsbiologie
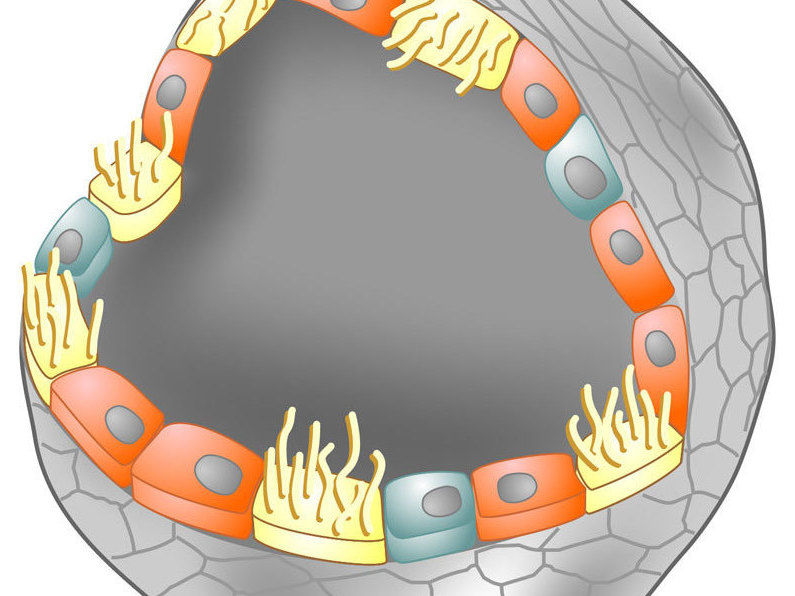
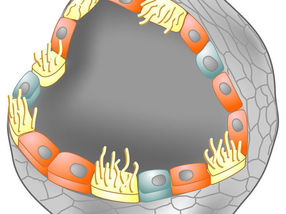
Grafische Darstellung eines Organoids des Eileiter-Epithels. Die Zellschicht weist wie bei einem natürlichen Eileiter verschiedene Zelltypen auf, darunter Zellen mit Flimmerhärchen (gelb).
© MPI f. Infektionsbiologie
Eileiter sind Teil der weiblichen Geschlechtsorgane. Wie zwei etwa zehn bis 15 Zentimeter lange Schläuche verbinden sie die Eierstöcke mit der Gebärmutter und ermöglichen so den Transport der reifen Eizelle in den Uterus. Sie sind also für eine erfolgreiche Fortpflanzung unverzichtbar.
„Eileiter können allerdings dauerhaft von Bakterien besiedelt werden“, erklärt Thomas F. Meyer, Leiter der Studie und Direktor am Max-Planck-Institut für Infektionsbiologie. Folglich sind sie häufig Ursprung von Infektionen, die etwa zu einem Verschluss der Leiter und schlimmstenfalls zu Unfruchtbarkeit führen können. „Neuere Erkenntnisse aus der Krebsforschung legen außerdem nahe, dass entartete Zellen aus den Eileitern in die Eierstöcke wandern“, fügt Meyer hinzu. Die Folge kann ein so genanntes Orvinalkarzinom sein, die tödlichste Form gynäkologischer Krebserkrankungen. Es gibt Hinweise darauf, dass Bakterien an der Entstehung dieser Krebsform beteiligt sind, belegt ist dies jedoch noch nicht.
Ärzte haben bislang kaum Möglichkeiten, das Innere der Eileiterröhren ihrer Patientinnen zu untersuchen. Dementsprechend werden Erkrankungen in diesem Bereich häufig erst im fortgeschrittenen Stadium diagnostiziert – und dann ist es oft zu spät für eine erfolgreiche Therapie. Auch ist es im Labor schwierig, Eileiter-ähnliche Bedingungen zu erzeugen. Die innere Schleimhaut der Eileiter, die Epithelzellschicht, ist dabei von besonderem Interesse, denn hier nehmen die Infektionen oder der Krebs oftmals ihren Anfang.
Das Team um Meyer hat in Zusammenarbeit mit Ärzten der Klinik für Gynäkologie der Charité in Berlin nun eine neue Methode entwickelt, diese innere Zellschicht im Labor wachsen zu lassen. Aus Eileiterproben von Spenderinnen haben sie Epithelzellen mit potenziellen Stammzelleigenschaften entnommen und kultivierten diese unter bestimmten Umgebungsbedingungen. Aus nur wenigen Zellen bildeten sich einzelne Hohlkugeln bestehend aus vielen tausend Zellen, so genannte Organoide. „Das geschah ganz ohne zusätzliche Instruktion. Der gesamte Bauplan des Eileiters ist also in den Epithelzellen gespeichert“, erläutert Meyer.
Die Anatomie, Struktur und die biochemischen Vorgänge in den Organoiden waren dabei denen eines echten Eileiters sehr ähnlich: „Die künstlichen Nachbildungen bestanden neben den Stammzellen auch aus Zellen mit Flimmerhärchen und sekretorischen Zellen, die alle wie in natürlichen Eileitern angeordnet waren“, so Meyer. Außerdem reagiert der künstlicher Eileiter auf die Zugabe von Hormonen zur Nährflüssigkeit. Diese und weitere übereinstimmende Merkmale beweisen, dass die verwendeten Ausgangszellen das Potential haben, zu spezialisierten Zellen auszureifen.
Die Wissenschaftler untersuchten zudem, wie die künstliche Schleimhaut entwickelt. Demnach steuern zwei Signalwege, dass ein einem echten Eileiter ähnliches Organoid entsteht: Notch und Wnt. Sie ermöglichen es den Zellen, auf äußere Signale zu reagieren. Insbesondere bei dem Aufbau von Gewebe im Embryo spielen beide eine wichtige Rolle. Je nach Entwicklungsstadium hemmen oder stimulieren sie beispielsweise weitere Veränderung der Zellen.
Die Forscher züchten die Organoide inzwischen über ein Jahr im Labor ohne merkliche Veränderungen. „Das ist ein großer Vorteil gegenüber entnommenen Eileitern. Deren Gewebe stirbt nach kurzer Zeit das Gewebe ab, denn die Sauerstoff- und Nährstoffversorgung funktioniert dann nicht mehr“, sagt Meyer.
Das Organoid kann hingegen Wissenschaftlern über einen langen Zeitraum als Forschungsobjekt dienen.
Die Berliner Wissenschaftler erhoffen sich über diese ersten Ergebnisse hinaus neue Einsichten in grundlegende Mechanismen der Fortpflanzung oder der Krankheitsentstehung im Eileiter. „Mit unserem Modell können wir jetzt gezielt erforschen, ob Infektionen des menschlichen Eileiters und dem Auftreten von Krebs auslösen können“, sagt Meyer.