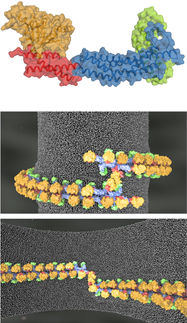
Architektur von mTOR-Proteinkomplex offengelegt
Seit langem ist das Protein TOR – Target of Rapamycin – dafür bekannt, dass es das Wachstum von Zellen steuert und an der Entstehung von Krankheiten wie Krebs und Diabetes beteiligt ist. Forscher vom Biozentrum der Universität Basel haben nun gemeinsam mit Kollegen der ETH Zürich die Struktur des TOR-Komplexes mTORC1 detailreich aufgeklärt.
3D-Modell des Proteinkomplexes mTORC1.
University of Basel, Biozentrum
Vor etwa 25 Jahren entdeckte Prof. Michael Hall am Biozentrum der Universität Basel das Protein «Target of Rapamycin» (TOR). Es ist eines der meistuntersuchten Proteine aus der Familie der Proteinkinasen. Diese Familie vereint wichtige regulatorische Proteine, die zahlreiche Prozesse in der Zelle kontrollieren. TOR, in Säugetieren mTOR genannt, steuert das Zellwachstum und ist daher an der Entstehung zahlreicher Krankheiten wie Diabetes, Krebs oder neurodegenerativer Krankheiten beteiligt. Einige Medikamente, die mTOR hemmen, wurden bereits zu Therapiezwecken zugelassen, insbesondere zur Behandlung von Krebs und gegen Abstossungsreaktionen bei Organtransplantationen.
Doch trotz der intensiven Erforschung von TOR in den letzten Jahrzehnten scheiterte bislang der Versuch, den Aufbau der Proteinkinase und seiner Partner im Detail aufzuklären. Dies ist nun dem Team von Prof. Timm Maier und Prof. Michael Hall vom Biozentrum der Universität Basel gemeinsam mit Forschern der ETH Zürich gelungen. Kristallographische und elektronenmikroskopische Analysen lieferten noch nie dagewesene Einblicke in die Architektur des Proteinkomplexes mTORC1.
Struktur von mTORC1 aufgeklärt
In der Zelle liegt die Proteinkinase mTOR in zwei strukturell und funktionell unterschiedlichen Proteinkomplexen vor, die auch als mTORC1 und mTORC2 bezeichnet werden. Diese beiden Komplexe sind riesige Strukturen, die neben mTOR aus weiteren Proteinen bestehen. In diesen beiden Konstellationen übt die Proteinkinase verschiedene Funktionen aus. Es kontrolliert das Wachstum und die Grösse von Zellen, regelt den Stoffwechsel und den Energiehaushalt.
mTOR selbst ist eines der grössten Proteine in der Zelle und im Verbund mit anderen Proteinen um noch einiges grösser. Dies macht es so schwierig den Aufbau zu untersuchen. «Durch biochemische Analysen war schon länger bekannt, mit welchen Proteinen mTOR eine Verbindung eingeht», sagt Maier. «Aber man hatte absolut keine Idee, wie sich die Proteine zusammenfügen.» Den Forschern um Timm Maier ist es nach mehr als drei Jahren gelungen, mTORC1 in einer Qualität herzustellen, die für die hochauflösende Analyse am Kryo-Elektronenmikroskop notwendig ist. Gleichzeitig konnten sie mittels Röntgenkristallographie die Struktur des Proteins Raptor, den zweiten Hauptbestandteil von mTORC1, bestimmen.
Proteine im Komplex sind wichtig für Funktion
«Obwohl schon vieles zu mTORC1 bekannt war, brachten unsere Ergebnisse dennoch überraschend Neues zu Tage», so Maier. «Die Architektur des riesigen Proteinkomplexes ist einzigartig. Wir konnten nun zeigen, an welchen Stellen und wie genau die verschiedenen Proteine miteinander interagieren und damit auch, welche Funktionen die einzelnen Partner übernehmen.» So spielen die einzelnen Proteine eine wichtige Rolle bei der Regulation der Aktivität des gesamten Komplexes und damit für die Signalweiterleitung in der Zelle.
Mehr als die Summe seiner Teile
Mit ihrer Studie haben die Forscher die Basis für weitere Untersuchungen gelegt. So kann nun die Funktion jedes einzelnen Proteins im gesamten Komplex genau erforscht werden. «Es ist wenig sinnvoll, sich nur die Einzelteile anzuschauen, denn die Interaktionen aller Proteine in dem Verbund sind entscheidend für dessen Funktion», sagt Maier. «Das Ganze ist weit mehr als nur die Summe seiner Teile.» Eine feine Regulation der mTOR-Aktivität ist äusserst wichtig, denn kleinste Störungen können schwere Konsequenzen nach sich ziehen. So kann eine Fehlregulation zu einer Vielzahl von Erkrankungen führen.