Anti-Leukämie-Medikament auf der Zielgeraden
Blinatumomab ist ein Wirkstoff, der dem Immunsystem von Krebspatienten hilft, Tumorzellen zu erkennen und zu vernichten. Nachdem das Medikament vor knapp einem Jahr bereits für den US-Markt zugelassen wurde, empfahl kürzlich auch der Ausschuss für Humanarzneimittel der Europäischen Arzneimittelagentur EMA die EU-Zulassung. Man kann nun davon ausgehen, dass der zu großen Teilen am Universitätsklinikum Würzburg entwickelte und erprobte Antikörper bald als reguläres Arzneimittel eingesetzt werden kann.
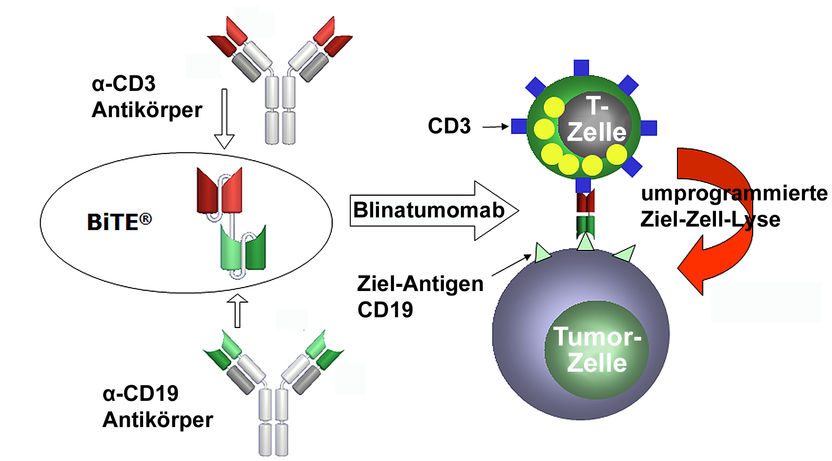
Das Wirkungsprinzip des Anti-Leukämie-Medikaments Blinatumomab.
Universitätsklinikum Würzburg
Ende September dieses Jahres teilte das Pharmaunternehmen Amgen mit, dass der Ausschuss für Humanarzneimittel der Europäischen Arzneimittelagentur EMA die EU-Zulassung von Blinatumomab zur Behandlung von Erwachsenen mit rezidivierter akuter lymphatischer Leukämie (ALL) empfiehlt. „Wir gehen jetzt davon aus, dass das Medikament nach einigen weiteren, untergeordneten Formalitäten vermutlich noch vor Ende dieses Jahres als reguläres Arzneimittel zur Verfügung steht“, freut sich Prof. Ralf Bargou vom Universitätsklinikum Würzburg (UKW). Der Direktor des am UKW angesiedelten Comprehensive Cancer Centers (CCC) Mainfranken war zusammen mit der Leiterin der Early Clinical Trial Unit (ECTU), Dr. Marie-Elisabeth Goebeler, und Prof. Max Topp, dem Leiter des Bereichs Hämatologie an der Medizinischen Klinik II des UKW, entscheidend an der Entwicklung und Erprobung des gentechnisch erzeugten Antikörpers beteiligt.
Uniklinikum Würzburg maßgeblich an internationalen Studien beteiligt
Während in den USA seit der behördlichen Zulassung von Blinatumomab (Produktname Blincyto) im Dezember 2014 Patienten mit akuter lymphatischer Leukämie, die auf herkömmliche Chemotherapie nicht ansprechen oder einen Rückfall erleiden, regulär mit dieser neuen Immuntherapie behandelt werden können, ist das Medikament in Deutschland und anderen europäischen Staaten zur Zeit nur im Rahmen von Studien erhältlich. An der Durchführung dieser Studien einschließlich der Zulassungsstudie war das Würzburger Universitätsklinikum – und hier insbesondere die Medizinische Klinik II unter Leitung von Prof. Hermann Einsele – entscheidend beteiligt.
„Dank des Einsatzes von Blinatumomab können wir für mehr als ein Drittel der erwachsenen Patienten mit einem Leukämierückfall eine komplette und nachhaltige Krankheitsremission erreichen, was für diese schwerkranken Patienten ein sehr gutes Ergebnis darstellt“, schildert Prof. Topp, der diese Studie leitete. Aktuell läuft unter dem Namen „Tower-Studie“ eine große, internationale Therapiestudie, in der Blinatumomab mit einer Standardchemotherapie verglichen wird. „Wir waren hier sehr erfolgreich in der Rekrutierung von passenden Patienten, sodass Würzburg in dieser weltweite Studie nach dem US-amerikanischen Krankenhaus City of Hope in Pasadena die zweitmeisten Patienten in die Studie einbringen konnte“, berichtet Prof. Topp.
So funktioniert Blinatumomab
Eine der großen Hoffnungen der internationalen Krebsforschung beruht darauf, das körpereigene Immunsystem des Patienten gegen die Tumorzellen zu wenden. Zu den stärksten Waffen der Immunabwehr zählen die T-Zellen. Leider können diese „Killer“ Krebszellen in der Regel nicht von gesunden Zellen unterscheiden und greifen sie deshalb auch nicht an. Um diese biochemische Blindheit zu überbrücken, gelang es Prof. Bargou und seinem Team zusammen mit Forschern aus München, gentechnisch einen Antikörper zu designen, der einerseits in der Lage ist, an der Krebszelle anzudocken und andererseits an T-Zellen binden kann. Mit Hilfe dieses „Adapters“ werden die Abwehrzellen aktiviert, sie erkennen die schädlichen Zellen und können sie in der Folge zerstören.
Als klinisch wirksam erwies sich Blinatumomab bislang bei der akuten lymphatischen Leukämie und bei Non-Hodgkin-Lymphomen. Bei der Vielzahl der in Studien damit behandelten Patienten war zumindest ein teilweiser, häufig auch ein kompletter Rückgang der Tumorzellen zu beobachten.
Knapp 20 Jahre lang trieb die Münchener Biotechnologie-Firma Micromet als kommerzieller Partner die Entwicklung von Blinatumomab voran, bevor das Unternehmen und sein aussichtsreicher Medikamentenkandidat im Jahr 2012 vom US-amerikanischen Biotech-Konzern Amgen übernommen wurde.