Nano-Stromnetze zwischen Bakterien
Mikroorganismen im Meer versorgen sich über winzige Stromkabel mit Energie und knacken so das Treibhausgas Methan
Strom wie aus der Steckdose - diese bequeme Art der Energieversorgung bewahrheitet sich scheinbar für bestimmte Mikroorganismen. Die Zellen können ihren Energiebedarf in Form von elektrischem Strom über Nano-Drahtverbindungen decken. Diese wahrscheinlich kleinsten Stromnetze der Welt haben Forscher vom Max-Planck-Institut für marine Mikrobiologie in Bremen entdeckt, als sie Zellaggregate Methan-abbauender Mikroorganismen untersuchten. Diese bestehen aus zwei völlig verschiedenen Zelltypen, die Methan nur gemeinsam abbauen können. Die Wissenschaftler haben kabelartige Verbindungen zwischen den Zellen gefunden, mit denen die Organismen ihren Energieaustausch organisieren.
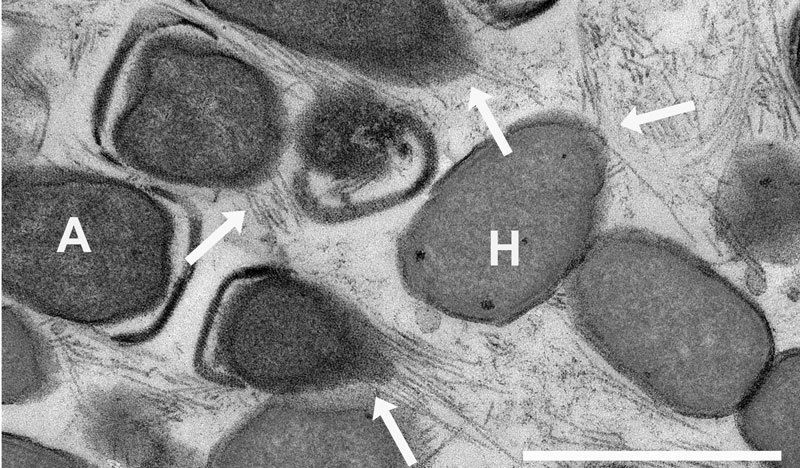
Das Elektronenmikroskopie-Bild zeigt die mehrere Mikrometer langen Nano-Drähte (Pfeile; weißer Balken = 1 Mikrometer). Sie sind damit viel länger als die Bakterienzellen selbst (A = Archaeen, H = Partnerbakterien).
© MPI f. Biophysical Chemistry
Es war eine wissenschaftliche Sensation, als im Jahre 2010 Forscher erstmals Strom leitendende Verbindungen zwischen verschiedenen Mikroorganismen fanden. Es stellte sich die Frage, ob elektrischer Strom als Energieträger auch für andere mikrobielle Prozesse in der Natur in Frage kommt. Einer dieser Prozesse ist der Abbau von Methan in Bereichen des Meeresbodens, in denen kein molekularer Sauerstoff vorhanden ist. Dieser Vorgang wird auch als anaerobe Oxidation von Methan bezeichnet, kurz AOM. Er ist ein klimarelevanter Prozess. Die Bremer Forscher haben die beteiligten Mikroorganismen im Jahr 2000 erstmals beschrieben und seitdem intensiv untersucht.
In den tiefen Schichten des Meeresbodens bildet sich Methan aus abgestorbener Biomasse. Dieses Gas steigt zunächst auf, doch noch vor dem Austritt ins Meer wird es im Meeresboden durch ganz spezielle Gemeinschaften (Konsortien) von bestimmten Typen von Bakterien und Archaeen abgebaut. Die Archaeen nehmen das Methan auf und oxidieren es zu Karbonat. Dabei entstehende Energie muss den Partnerbakterien übergeben werden, damit der Prozess ablaufen kann. Die Bakterien veratmen dann statt Sauerstoff Sulfat, um ebenfalls Energie zu gewinnen (Sulfatreduzierer). Dieser Prozess findet wahrscheinlich seit Milliarden von Jahren statt, und hat schon den Methangehalt in der sauerstofffreien Atmosphäre der jungen Erde beeinflusst. Wie die Energie zwischen den Bakterien jedoch übertragen wird, war bis vor kurzem ein Rätsel.
Gunter Wegener, zusammen mit der Doktorandin Viola Krukenberg Erstautor der jetzt publizierten Studie, sagt: „Unser Team hat sich besondere AOM-Konsortien angeschaut, die bei 60 Grad Celsius leben. Hier gelang es erstmals, das Partnerbakterium allein wachsen zu lassen. Dann haben wir diese Kultur und die AOM-Kultur systematisch unter verschiedenen Bedingungen getestet und verglichen. Wir wollten wissen, welche Stoffe als Energieträger zwischen den Archaeen und dem Sulfatreduzierer in Frage kommen.“
Die meisten Verbindungen konnten die Forscher schnell ausschließen. Gaben die Forscher jedoch Wasserstoff und Methan gemeinsam zu den Konsortien, wurde kein Methan mehr abgebaut, stattdessen nutzten die Sulfatreduzierer den Wasserstoff. Erst als dieser aufgebraucht war, lief die Methanoxidation wieder an. Wasserstoff könnte ein Zwischenprodukt sein, allerdings produzierten Archaeen nicht ausreichend davon, um das Wachstum der Sulfatreduzierer zu erklären.
Direkte Stromkabel und Elektronentransporter
Es blieb als mögliche Alternative eine direkte Stromverbindung zwischen den Zellen. Für die AOM-Kulturen traf diese Vermutung ins Schwarze. Dietmar Riedel, Leiter der Elektronenmikroskopie am Max-Planck-Institut für biophysikalische Chemie in Göttingen sagt: „Die Schwierigkeit bestand darin, diese Verbindungen auch sichtbar zu machen. Dafür mussten wir die Proben unter Hochdruck einfrieren und in Epoxidharz einbetten. Danach konnten ultradünne Schnitte der so präparierten Probe in nahezu natürlichem Zustand am Transmissionselektronenmikroskop untersucht werden.“ Viola Krukenberg ergänzt: „Wir haben alle notwendigen Gene für den Elektronentransport gefunden und gezeigt, dass sie durch Methan und Sulfat aktiviert werden.“
Mit Methan als Energiequelle wachsen kabelartige Strukturen, so genannte Pili, von den Bakterien zu den Archaeen und docken dort an. Die Kabel sind bis zu mehrere Mikrometer lang, also länger als eine Zelle. Sie sind mit wenigen Nanometern aber sehr dünn. Die Kabel schaffen den Kontakt zwischen den eng benachbarten Zellen. Dies erklärt auch die räumliche Struktur des Konsortiums, wie von einem Team von Forschern um Victoria Orphan von Caltech gezeigt wurde.
„In der Natur gibt es eine erhebliche Vielfalt von den Archaea-Bakterien-Konsortien. Als nächstes möchten wir herausfinden, ob die Stromkabel auch bei anderen Konsortien vorkommen. Wir wollen wissen, wie diese Gemeinschaften funktionieren und wie sie ihren Stoffwechsel regeln, weil dadurch entscheidende Prozesse in der Natur gesteuert werden“, beschreibt Antje Boetius, die Leiterin der Arbeitsgruppe am Bremer Max-Planck-Institut.