50 Jahre altes Rätsel gelöst: Warum sich bestimmte Zellen abstossen
Wenn Zellen aus dem Bindegewebe aufeinanderprallen, stossen sie sich ab – dieses Phänomen wurde bereits vor über 50 Jahren entdeckt. Erst jetzt haben Forscher an der Universität Basel die molekularen Grundlagen dieses Prozesses aufgedeckt. Ihre Erkenntnisse könnten für die Krebsforschung wichtig werden.
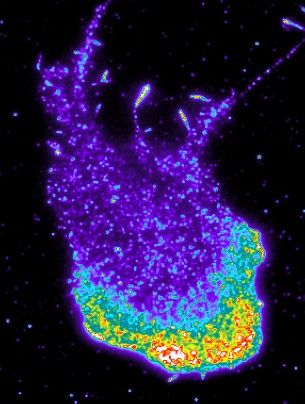
Beweglicher Fibroblast: Das Protein srGAP2, das die Abstossungsreaktion einleitet, ist an der Zellfront stark konzentriert (unten, in Rot, Gelb und Grün).
© University of Basel, Prof. Pertz’s research group
Fibroblasten sind bewegliche Bestandteile des Bindegewebes, dessen Festigkeit sie auch regulieren. Darüber hinaus spielen Fibroblasten eine wichtige Rolle bei malignen Hauterkrankungen wie etwa dem Melanom. In der Forschung dienen sie als Modellsystem, um die Wanderung der Zellen zu studieren.
Signalkette identifiziert
In den frühen 1950er-Jahren entdeckte der britische Zellbiologe Michael Abercrombie, dass sich kollidierende Fibroblasten gegenseitig abstossen und dabei die Bewegungsrichtung ändern. Er nannte dieses Phänomen «contact inhibition of locomotion». Obwohl dabei einzelne Proteine als wichtige Faktoren identifiziert wurden, glichen die molekularen Grundlagen dieser Reaktion eher einem Puzzle im Anfangsstadium. Vor allem war ungeklärt, welche Abstossungssignale daran beteiligt sind, wie sie von aussen in die Zelle gelangen und wie sie das Zellskelett beeinflussen, das wiederum die Zellbewegung reguliert.
Die Forschungsgruppe von Prof. Olivier Pertz an der Universität Basel hat nun genau diese Fragen beantwortet. Sie identifizierte eine zusammenhängende Signalkette, die aus drei Proteinen namens Slit2, Robo4 und srGAP2 besteht und so funktioniert:
- Der Abstossungsfaktor Slit2 bindet an den Rezeptor Robo4, worauf das Signal ins Zellinnere gelangt und srGAP2 aktiviert.
- Dieses Molekül hemmt darauf den Regulator Rac1, der das Zellskelett koordiniert.
- Durch die Inaktivierung von Rac1 zieht sich die Zelle zurück, sodass sich zwei Zellen abstossen.
Schaltet man die Funktion von Slit2, Robo4 oder srGAP2 aus, bleiben zusammenstossende Zellen aneinander kleben und kommen nicht so leicht wieder voneinander weg.
Eine «molekulare Stossstange»
Das Besondere an dieser Signalkette ist, dass sie sich vorne an der Zellfront befindet, und zwar auch dann, wenn Zellen nicht miteinander kollidieren, sondern sich frei bewegen. Indem in der Zelle eine Art «molekulare Stossstange» zusammengesetzt wird, ist für den Fall einer Kollision zwischen Zellen vorgesorgt. Wo genau diese Stossstange platziert werden muss – nämlich nur in sich nach vorne bewegenden Teilen der Zelle –, wird durch die Zellgeometrie bestimmt, die wiederum vom Protein srGAP2 dechiffriert wird.
Durch die Integration von Membrankrümmung und Abstossungssignalen wird somit sichergestellt, dass die Zell-Zell-Abstossung an der richtigen Stelle stattfindet. Diese Abstossungsreaktion könnte eine wichtige Rolle bei der Metastasierung von Krebs spielen. Dafür spricht, dass die Expression von Slit und Robo bei mehreren Krebsarten dereguliert ist.
Originalveröffentlichung
Rafael Dominik Fritz, Denis Menshykau, Katrin Martin, Andreas Reimann, Valeria Pontelli, and Olivier Pertz; SrGAP2-Dependent Integration of Membrane Geometry and Slit-Robo-Repulsive Cues Regulates Fibroblast Contact Inhibition of Locomotion; Developmental Cell (2015)
Meistgelesene News
Originalveröffentlichung
Rafael Dominik Fritz, Denis Menshykau, Katrin Martin, Andreas Reimann, Valeria Pontelli, and Olivier Pertz; SrGAP2-Dependent Integration of Membrane Geometry and Slit-Robo-Repulsive Cues Regulates Fibroblast Contact Inhibition of Locomotion; Developmental Cell (2015)
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.