Was den Golgi im Innersten zusammenhält
Nachdem Proteine am Endoplasmatischen Retikulum gebildet wurden, gelangen sie in den Golgi-Apparat und durchwandern die verschiedenen Zisternen. Dabei erhalten sie eine Vielzahl von Modifikationen und werden für den Transport an ihren Bestimmungsort innerhalb oder außerhalb der Zelle in Vesikel verpackt.
Die spezifische Architektur des Golgi-Apparates ist essentiell, um das Modifizieren und Sortieren der Proteine zu steuern. In den verschiedenen Zisternen befinden sich unterschiedliche Golgi-Enzyme, welche die jeweils nötigen Modifikationen vornehmen. Doch wie entsteht dieser ausgeklügelte Aufbau? Max-Planck-Wissenschaftler konnten nun Licht ins Dunkel bringen, indem sie den Golgi-Apparat der Alge Chlamydomonas mit Hilfe der in situ Kryo-Elektronentomografie näher untersuchten.
Bisher konnten Forscher nur herkömmliche Methoden der Elektronenmikroskopie nutzen, um zelluläre Strukturen zu untersuchen. Die Schritte, die bei diesen Methoden zur Vorbereitung notwendig waren, schädigten die Proben und machten es Forschern unmöglich, feine molekulare Details zu beobachten. Wissenschaftler aus der Abteilung „Molekulare Strukturbiologie“ um Wolfgang Baumeister haben daher eine neue Methode entwickelt: die in situ Kryo-Elektronentomografie. Die Zelle wird schockartig gefroren, um so ihre filigranen Strukturen zu erhalten. Dann schneiden die Forscher mit einem fokussierten Ionenstrahl winzige „Fenster“ in die Zelle und legen so ihr Innerstes frei. Mit einem Elektronenmikroskop erhalten sie anschließend einen ungetrübten Blick in das Innere der Zelle.
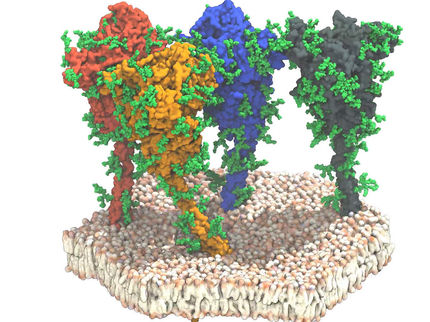
Experten nahmen lange an, dass die Zisternen des Golgi-Apparats nicht von Linkerproteinen zusammengehalten werden. Erst die Kryo-Elektronentomografie konnte die regelmäßigen Proteinanordnungen aufspüren.

Wie ein Reißverschluss halten Linkerproteine (farbig dargestellt) die Zisternen des Golgi-Apparates zusammen.
MPI für Biochemie
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Ammoniumchlorid
S-100-Protein
Gericht kassiert Patentstreit-Urteil zugunsten von US-Konzern Merck

Erstmals in Europa: Virologen können jetzt Infektionsprozesse an lebenden Zellen mikroskopieren
Albtraum
Wirkstoff weckt Hoffnung auf Heilung von Hepatitis E - Substanz aus Mahagonigewächse hemmt Virenvermehrung in Zellkultur und Mäusen
Wilhelm_His_(Internist)