NMR-Spektroskopie an großen Proteinen: Neue Perspektiven für die Entwicklung von Antibiotika
Wie müssen Antibiotika beschaffen sein, damit Bakterien nicht dagegen resistent werden? Die Forschungsgruppe um Prof. Dr. Paul Rösch an der Universität Bayreuth ist bei der Beantwortung dieser Frage einen grundlegenden Schritt vorangekommen. Erstmals konnten das riesige Protein RNA-Polymerase und seine Wechselwirkungspartner mithilfe der magnetischen Kernresonanzspektroskopie (NMR-Spektroskopie) im Detail untersucht werden. Die Ergebnisse sind jetzt in "Scientific Reports" veröffentlicht. Weitere Erkenntnisse versprechen sich die Forscher von einem weltweit einzigartigen 1 GHz-Spektrometer mit aktiv abgeschirmtem Magnetfeld, das in Kürze auf dem Bayreuther Campus installiert wird.
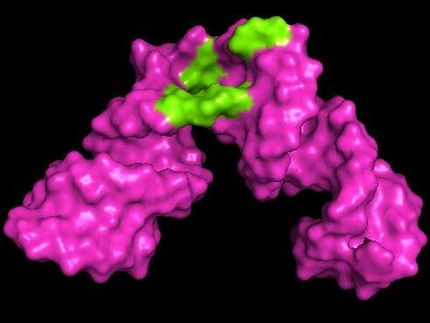
Kleine und mittelgroße Proteine binden an die bakterielle RNA-Polymerase.
Grafik: Dr. Stefan Knauer, Universität Bayreuth
Aktuell gehört zu den größten Herausforderungen der Medizin die Abwehr von Bakterien, gegen die alle derzeit zur Verfügung stehenden Antibiotika unwirksam sind. Die meisten dieser Antibiotika richten sich gegen bakterielle Zellwände und deren Bestandteile, oder sie stören die Synthese bakterieller Proteine. Neuere Antibiotika wiederum richten sich gegen das Kopieren von bakteriellen Erbinformationen. Die Problematik ist dabei die gleiche: Einige Bakterien entwickeln Mechanismen, die sie gegen diese – eigentlich tödlichen – Substanzen schützt. Sie werden resistent. Eine Chance, dieser Situation Herr zu werden, liegt für die Medizin in der Entwicklung neuartiger Wirkstoffe, die grundlegende Prozesse in der bakteriellen Zelle unterbrechen.
Ein Beispiel für einen solchen Prozess ist die Übersetzung der Erbinformation, die in der DNA gespeichert ist, in eine RNA-Sequenz. Hierbei handelt es sich um eine für die Proteinherstellung verwertbare Form der Erbinformation. Der als Transkription bezeichnete Übersetzungsprozess, der durch die RNA Polymerase (RNAP) katalysiert wird, ist hoch komplex und wird durch andere bakterielle Proteine, die an die RNAP binden, präzise gesteuert. Viele Details dieser bakteriellen Übersetzungsmaschinerie sind derzeit noch unbekannt. Genauere Kenntnisse könnten aber eines Tages die gezielte Konstruktion von Wirkstoffen erlauben, die genau diese Maschinerie lahmlegen – und die Bakterien daran hindern, resistent zu werden.
Erstmals NMR-spektroskopisch untersucht: die Wechselwirkung von kleinen Proteinen mit intakter RNAP
An genau diesem Punkt setzen die NMR-spektroskopischen Untersuchungen der Forschungsgruppe um Prof. Dr. Paul Rösch an, die zu den neuen, in "Scientific Reports" – einer Zeitschrift der "Nature Publishing Group" – veröffentlichten Ergebnissen geführt haben. Die räumlichen, dreidimensionalen Strukturen der an der Transkription beteiligten Moleküle sind bereits durch Röntgenstrukturanalyse und Elektronenmikroskopie untersucht worden. Im Vergleich zu diesen Techniken zeichnet sich die NMR-Spektroskopie aber dadurch aus, dass Wechselwirkungen von Molekülen und die Dynamik von Molekülstrukturen relativ einfach zu untersuchen sind. Gerade solche Prozesse spielen eine entscheidende Rolle bei der Transkription. Daher ist ihr Verständnis unabdingbar für die gezielte Entwicklung von Antibiotika.
Mit NMR-Spektroskopie sind nur bestimmte, nicht-radioaktive Atomsorten (Isotope) detektierbar, die durch molekularbiologische Methoden in Proteine eingebracht werden. Diese Isotope dienen als Sonden und ermöglichen wichtige Einblicke in molekulare Strukturen sowie in die Veränderungen, denen diese Strukturen unterliegen. Bislang konnte die NMR-Spektroskopie vorwiegend nur bei kleinen und mittelgroßen Proteinen eingesetzt werden. Die Bayreuther Arbeitsgruppe hat aber nun Wege gefunden, das sehr große und hoch komplexe Molekül RNAP der Untersuchung durch NMR-Spektroskopie zugänglich zu machen.
Die Bayreuther Wissenschaftler haben sich eine spezielle Technik zunutze gemacht, um ausschließlich bestimmte, sehr bewegliche Gruppen von Atomen, die nur in einzelnen Proteinbausteinen vorkommen, molekularbiologisch in definierter Art und Weise mit NMR-aktiven Isotopen zu markieren. Diese Gruppen waren trotz der Proteingröße beobachtbar und dienten den Wissenschaftlern als Sonden im Gesamtprotein. Gleichzeitig gelang es, die fünf Untereinheiten, aus denen die RNAP aufgebaut ist, einzeln herzustellen, individuell zu markieren und anschließend das Gesamtprotein wieder zusammenzusetzen. So konnte auch spezifisch eine einzelne Untereinheit innerhalb der gesamten RNAP detektiert werden.
In einem ersten Experiment konnte so gezeigt werden, an welche der Untereinheiten bestimmte Proteine binden. In einem zweiten Schritt wird zurzeit mittels eines analogen Markierungsverfahrens bestimmt, wie die Kontaktflächen zwischen den Bindeproteinen und der RNAP aussehen.
Grundlagen für die gezielte Entwicklung neuer Wirkstoffe
„Mit den von uns entwickelten Verfahren wollen wir die Wechselwirkungen zwischen der bakteriellen RNAP und kleineren Proteinen, die daran binden, so präzise wie möglich untersuchen. Zusammen mit unseren bereits veröffentlichten Erkenntnissen über das Zusammenspiel der Transkription mit der Proteinbiosynthese werden wir so ein gutes Bild davon erhalten, wie bakterielle Regulationsprozesse ablaufen. Vor allem werden wir Aufschluss darüber gewinnen, wie sich diese Prozesse von den entsprechenden Mechanismen im Menschen unterscheiden. Wir erwarten, dass sich auf dieser Basis neue Antibiotika entwerfen lassen, gegen die Bakterien nicht resistent werden können“, erklärt der Bayreuther Arbeitsgruppenleiter Dr. Stefan Knauer. Wie neue Wirkstoffe aussehen könnten, die das bakterielle System stören, aber das menschliche unbeeinflusst lassen, könne mit dem neuen Forschungsansatz weiter aufgeklärt werden.
NMR-Spektroskopie lässt auch die Untersuchung sehr großer Proteine zu
In Zusammenhang mit ihren NMR-spektroskopischen Untersuchungen ist den Bayreuther Strukturbiologen also ein Novum geglückt: Die erfolgreiche Anwendung der NMR-Spektroskopie auf ein sehr großes, aus unterschiedlichen Untereinheiten aufgebautes, multimeres Protein. „Wenn es darum geht, die Struktur von Proteinen dieser Größe zu bestimmen, wird sich die NMR-Spektroskopie auch in naher Zukunft nicht mit Elektronenmikroskopie und Röntgenstrukturanalyse messen können. Wir konnten mit unserer Arbeit aber zeigen, dass sich die Stärken der NMR-Spektroskopie, nämlich die Untersuchung von molekularen Interaktionen und molekularer Dynamik, auch auf sehr große Molekülkomplexe anwenden lassen“, erklärt Prof. Dr. Paul Rösch, Leiter des Lehrstuhls für Biopolymere und Direktor des Forschungszentrums für Bio-Makromoleküle der Universität Bayreuth. „Ein wesentlicher Durchbruch bei der Erforschung dieser hochmolekularen Komplexe wird die Installation des weltweit ersten 1 GHz-Spektrometers mit abgeschirmten Magneten an der Universität Bayreuth sein. Die Abschirmung des Magneten dient dazu, äußere Einflüsse auf die Messergebnisse zu minimieren“, so Prof. Rösch. Für seine Forschungen zu Allergenen und Antibiotika ist ihm vor kurzem der Ludwig-Schaefer-Preis der amerikanischen Columbia University verliehen worden.