Forscher identifizieren Gen, das Bluthochdruck und Kurzfingrigkeit auslöst
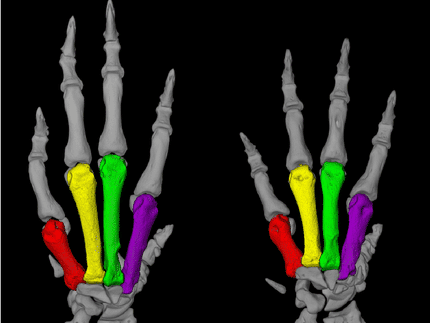
Die Betroffenen haben ererbten Bluthochdruck und zugleich eine Skelettfehlbildung (Brachydaktylie Typ E). Sie sterben vor dem 50. Lebensjahr, wenn ihr Bluthochdruck nicht behandelt wird. Nach über 20 Jahren Arbeit haben Forscher vom Experimental and Clinical Research Center (ECRC) des Max-Delbrück-Centrums (MDC) und der Charité jetzt das Gen identifiziert, das dieses ungewöhnliche und seltene Krankheitsbild auslöst. In sechs nicht miteinander verwandten Familien entdeckten sie sechs unterschiedliche Punktmutationen in dem Gen PDE3A. Diese führen stets zu Bluthochdruck und zu verkürzten Knochen der Extremitäten, insbesondere der Mittelhand- und Mittelfußknochen (Nature Genetics online).
Damit haben die MDC- und Charité-Forscher den ersten vererbten von Salz unabhängigen Bluthochdruck entschlüsselt. Er basiert nicht auf der Rückresorption von Salz durch die Niere sondern auf dem Aufbau und der Funktion der Gefäßwand.
„Als wir mit der Erforschung dieser Erkrankung 1994 anfingen und die größte der betroffenen Familien erstmals in der Türkei untersuchten, gab es weder die modernen Methoden der Gensequenzierung noch die umfangreichen Gendatenbanken“, erklärt PD Dr. Sylvia Bähring, Letztautorin der Publikation aus der Forschungsgruppe von Prof. Friedrich C. Luft, die lange Suche nach der Ursache dieses Erbleidens.
„Goldschatz der Genetik“
1996 war es der Forschungsgruppe durch den Vergleich der Erbanlagen der gesunden und erkrankten Familienmitglieder gelungen, die Chromosomenregion einzukreisen, innerhalb der das "Krankheitsgen" zu finden sein musste. Sie lag auf einem Abschnitt von Chromosom 12 und war geschätzte 10 Millionen Basenpaare groß. „Auf die Spur des Gens“, so Dr. Bähring, „hat uns dann aber letztlich ein 16 Jahre alter türkischer Junge gebracht. Er ist quasi unser Goldschatz der Genetik.“ Er hatte ebenfalls sehr hohen Blutdruck – er wird wie alle anderen Betroffenen mit blutdrucksenkenden Medikamenten behandelt – aber seine Hände sind fast normal ausgebildet. Nur die Mittelhandknochen seiner kleinen Finger sind leicht verkürzt.
Die Durchforstung der Erbanlagen mehrerer Betroffener mit Hilfe der Ganzgenomsequenzierung hat es Dr. Philipp G. Maass, Dr. Atakan Aydin, Prof. Luft, Dr. Okan Toka (früher MDC/Charité, jetzt Friedrich-Alexander-Universität Erlangen), Dr. Carolin Schächterle (MDC-Forschungsgruppe PD Dr. Enno Klußmann) sowie PD Dr. Bähring vor kurzem ermöglicht, das Gen und sechs unterschiedliche Punktmutationen in insgesamt sechs Familien aus der ganzen Welt dingfest zu machen. Es ist das Gen PDE3A, das den Bauplan für das Enzym Phosphodiesterase 3A enthält. Die sechs verschiedenen Punktmutationen, die die Forscher in dem PDE3A-Gen aufspürten, führten zum Austausch eines einzelnen, in jeder Familie eines anderen, DNA-Bausteins. Durch jeden Austausch wird jeweils eine Aminosäure des Enzyms verändert.
Ein Gen – zwei unterschiedliche Krankheitsbilder
Aber wie kann ein Gen, wenn es mutiert ist, zwei so unterschiedliche Krankheiten wie Bluthochdruck und Kurzfingrigkeit auslösen? Die Erklärung dafür liefern die ECRC-Forscher in ihrer Forschungsarbeit gleich mit. Die Aufgabe der Phosphodiesterase des Gens PDE3A ist es, die Menge der in allen Zellen vorkommenden beiden sekundären Botenstoffe, des cAMP (Cyclisches Adenosinmonophosphat) und des cGMP (Cyclisches Guanosinmonophosphat), zu kontrollieren und damit die Dauer ihrer Aktivität zu regulieren.
Die Mutationen im Gen PDE3A führen jedoch dazu, dass das Enzym Phosphodiesterase verstärkt aktiv ist, und somit zu viel von dem sekundären Botenstoff cAMP (Cyclisches Adenosinmonophosphat) zu AMP (Adenosinmonophosphat) umbaut, die Zelle also zu wenig cAMP zur Verfügung hat. Die Folge davon ist, dass sich die glatten Muskelzellen der Gefäßwand kleiner Arterien bei betroffenen Familienmitgliedern vermehrt teilen. Dadurch verdickt die Gefäßmuskelschicht und die Blutgefäße verengen und versteifen, was den Blutdruck in die Höhe treibt. Außerdem führt ein zu geringer cAMP-Spiegel in den Gefäßmuskelzellen auch zu einer erhöhten Kontraktion der Blutgefäße.
Was aber machen erniedrigte cAMP-Spiegel in der Entwicklung der Extremitätenknochen? Das Gen, das die Skelettfehlbildung Brachydaktylie Typ E auslöst, ist PTHLH (engl. parathyroid hormone like hormone). In Knorpelzellen bindet in der Steuerregion des Gens ein Transkriptionsfaktor (CREB), der durch cAMP aktiviert wird. Dieser Faktor sorgt dafür, dass das Gen abgelesen wird und das Knorpelwachstum beeinflussen kann. Ist zu wenig cAMP in der Knorpelzelle, ist dieser Mechanismus gestört. Das führt dann zur Verkürzung der Mittelhand- und Mittelfußknochen und damit zur Verkürzung von Fingern und Zehen. So kann eine Punktmutation durch die Veränderung der zellulären Signalweitergabe in einem Menschen zwei unterschiedliche Krankheiten hervorrufen.
Neue Sicht auf Bluthochdruckentstehung
Die Forscher weisen darauf hin, dass der von ihnen in den Familien untersuchte Bluthochdruck unabhängig vom Salzkonsum der Betroffenen ist. Bisher geht die Forschung davon aus, dass zu viel Salz in der Nahrung die Nieren schädigt und damit den Blutdruck in die Höhe treibt. „Wir haben in unserer Studie gezeigt, dass für die Entstehung dieser genetisch vererbbaren Form des Bluthochdrucks ausschließlich die Blutgefäße von Bedeutung sind und nicht direkt die Niere“, hebt PD Dr. Bähring die Bedeutung dieser Forschungsarbeit hervor.
Erstbeschreibung der Krankheit 1973
1973 hatte der türkische Arzt Prof. Nihat Bilginturan von der Universität Haceteppe in Ankara, Türkei, erstmals das von den Forschern in Berlin jetzt entschlüsselte Krankheitsbild beschrieben. Ihm war aufgefallen, dass in einer Großfamilie an der Schwarzmeerküste einige Mitglieder mit verkürzten Fingern und Zehen – Mediziner nennen das Brachydaktylie (von griechisch brachus für kurz und daktylos für Finger) – seltsamerweise alle schon in jungen Jahren einen sehr hohen Blutdruck haben und relativ früh sterben. Unbehandelt führt der Bluthochduck, der bei den Betroffenen im Schnitt 50 mm Hg über dem Normalwert von 140/90 mm Hg liegt, noch vor dem 50. Lebensjahr zum Tod, meist durch einen Schlaganfall. Entdeckt hatte die Publikation und damit den Stein ins Rollen gebracht der Genetiker Prof. Thomas Wienker (früher MDC und Universität Bonn, jetzt Max-Planck-Institut für Molekulare Genetik, Berlin).