Magnetresonanz am einzelnen Protein
Mit einem besonders empfindlichen magnetischen Sensor lässt sich die Form und Bewegung von Biomolekülen beobachten
Kernspin-Untersuchungen erleichtern Ärzten und Biologen enorm die Arbeit. Die Technik ist nicht nur das Mittel der Wahl für viele medizinische Diagnosen, sie offenbart auch immer mehr Details über die Chemie des Lebens. Ein deutsch-chinesisches Team, an dem auch Forscher des Max-Planck-Instituts für Festkörperforschung in Stuttgart beteiligt sind, präsentiert jetzt sogar eine Magnetresonanz-Studie an einem einzelnen Protein. Die Biophysiker setzen dabei auf die Prinzipien, die auch die Kernspin-Untersuchungen der Radiologie ermöglichen, sie nutzen allerdings einen viel empfindlicheren Sensor. So beobachten sie, wie sich das Protein bewegt, und zwar bei Raumtemperatur und in einem Milieu, das dem Zellinneren ähnelt. Damit zeigen die Wissenschaftler, dass es grundsätzlich möglich ist, einzelne Proteine und ihr Zusammenspiel in Zellen zu verfolgen, um Ursachen und Therapieansätze für Krankheiten zu finden.
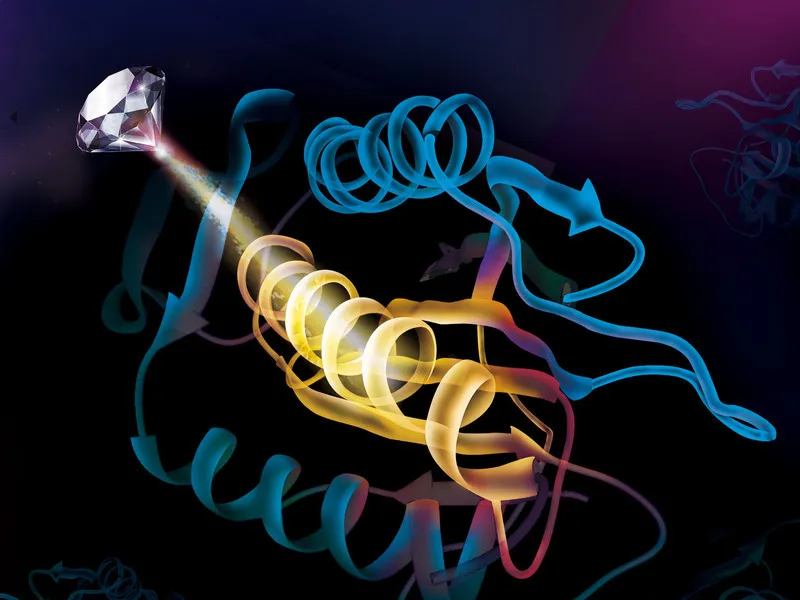
Brillanter Blick auf ein Protein: Ein NV-Zentrum, an dem in einem Diamanten ein Stickstoffatom sitzt, dient einem deutsch-chinesischen Team als besonders empfindlicher Sensor, um die Form und die Bewegung eines einzelnen Moleküls des Proteins MAD-2 zu untersuchen.
© University of Science and Technology of China, Hefei
Proteine sind die Werkzeuge des Lebens. Und wie ein Schraubenzieher in Gestalt eines Hammers keine Schraube dreht, erledigen sie ihre unzähligen Aufgaben im Körper nur, wenn sie die richtige Form oder Konformation besitzen. Manche Proteine müssen ihre Form wie eine auf- und zuklappende Zange auch ändern, um richtig zu funktionieren – Biologen sprechen dann von einer Konformationsänderung. Erledigen Proteine ihre Aufgaben nicht formvollendet, stottert die biochemische Maschinerie, und wir werden krank.
„Um die Funktion der Proteine zu verstehen und mögliche Krankheitsursachen zu erkennen, wollen wir Proteine möglichst in einer Zelle beobachten“, sagt Jörg Wrachtrup, Professor an der Universität Stuttgart und Fellow des Max-Planck-Instituts für Festkörperforschung. „Diesem Ziel sind wir jetzt einen großen Schritt näher gekommen.“ In einem Team, das Forscher der Universität im chinesischen Hefei leiteten, ist es ihm nun erstmals gelungen, mit der Magnetresonanz-Technik unter nahezu physiologischen Bedingungen zu verfolgen, wie sich ein einzelnes Exemplar des Proteins MAD-2 bewegt. MAD-2 trägt dazu bei, dass die Zellteilung reibungslos vonstatten geht.
Ein Fehler im Diamanten dient als besonders empfindlicher Sensor
Um zu prüfen, ob Proteine für solche Aufgaben in Form sind, hat Jörg Wrachtrup mit seinen Mitarbeitern einen Sensor mit der geeigneten Empfindlichkeit entwickelt. Kern dieses Sensors ist eine Fehlstelle in einem Diamanten, an der in dem Kohlenstoffgerüst des Edelsteins ein Stickstoffatom sitzt. Die Physiker nennen diesen Defekt NV-Zentrum, kurz für nitrogen vacancy center. An dieser Stelle sitzt ein Elektron, das anders als die anderen Elektronen im Diamantgitter keinen Partner hat. Sein Spin macht dieses Elektron zu einer Art winzigem Stabmagneten.
In welche Richtung sich der elektronische Stabmagnet am NV-Zentrum orientiert, lässt sich daran erkennen, wie stark der Stickstoff-Defekt in einem Lichtstrahl leuchtet. Die Orientierung des Stabmagneten hängt dabei von den magnetischen Einflüssen aus seiner unmittelbaren Umgebung ab. Die können etwa von den Kernspins der Wasserstoffatome in einem Protein herrühren, das die Forscher über dem NV-Zentrum platzieren.
Die Wirkung der Kernspins ist allerdings so schwach, dass die Forscher auf diese Weise nur einen winzigen Schnipsel des Proteins sehen könnten. Daher versehen sie das Protein mit einer Art magnetischen Verstärker: einem kleinen organischen Molekül, das ebenfalls einen einzelnen Elektronenspin und damit einen kleinen Stabmagneten trägt. Wie der Stabmagnet an dem Verstärkermolekül sein Pendant am NV-Zentrum beeinflusst, verrät den Forschern bis zu einer Entfernung von etwa zehn Nanometern nicht nur etwas über die Lage und Bewegung ihres Testproteins MAD-2. Das Verstärkermolekül übermittelt auch Informationen über die Kernspins des Proteins.
Mit Mikrowellenpulsen wird das magnetische Rauschen gefiltert
Um diese Information aus MAD-2 heraus zu kitzeln, muss das chinesisch-deutsche Team jedoch einen Trick anwenden. Denn die Forscher lösten das Protein in Polylysin, Ketten der Aminosäure Lysin, und simulierten auf diese Weise das Durcheinander an Proteinen in einer Zelle. Polylysin beeinflusst den Magnetsensor am NV-Zentrum jedoch ebenfalls stark. In diesem magnetischen Rauschen ginge der Einfluss von MAD-2 einfach unter. „Wir können den Spin-Sensor am NV-Zentrum aber so gut kontrollieren, dass wir das Rauschen des Polylysins herausfiltern“, sagt Jörg Wrachtrup. Mit einer Folge von Mikrowellenpulsen manipulieren die Wissenschaftler den Stabmagneten am NV-Zentrum. Der Sensor reagiert dann nur noch auf bestimmte magnetische Einflüsse, Störsignale bleiben so wirkungslos.
Ihre Technik wollen die Forscher nun auf Proteine in Zellen anwenden. „Einzelne Proteine lassen sich zwar schon mit der optischen Nanoskopie sichtbar machen“, sagt Jörg Wrachtrup. „Diese Methoden liefern jedoch keine Information über die Konformation und Dynamik eines Proteins.“ Der Diamantsensor soll da Abhilfe schaffen. Er soll Biochemikern künftig zeigen, ob Proteine bei ihren Aufgaben die richtige Form wahren.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Proteinanalytik
Die Proteinanalytik ermöglicht einen tiefen Einblick in diese komplexen Makromoleküle, ihre Struktur, Funktion und Wechselwirkungen. Sie ist unerlässlich für die Entdeckung und Entwicklung von Biopharmazeutika, das Verständnis von Krankheitsmechanismen und die Identifizierung von therapeutischen Zielen. Durch Techniken wie Massenspektrometrie, Western Blot und Immunoassays können Forscher Proteine auf molekularer Ebene charakterisieren, ihre Konzentration bestimmen und mögliche Modifikationen identifizieren.

Themenwelt Proteinanalytik
Die Proteinanalytik ermöglicht einen tiefen Einblick in diese komplexen Makromoleküle, ihre Struktur, Funktion und Wechselwirkungen. Sie ist unerlässlich für die Entdeckung und Entwicklung von Biopharmazeutika, das Verständnis von Krankheitsmechanismen und die Identifizierung von therapeutischen Zielen. Durch Techniken wie Massenspektrometrie, Western Blot und Immunoassays können Forscher Proteine auf molekularer Ebene charakterisieren, ihre Konzentration bestimmen und mögliche Modifikationen identifizieren.