Zweisamkeit im menschlichen Erbgut
Die Genome der Menschen sind außerordentlich individuell – eine Herausforderung für die personalisierte Medizin
Der Mensch ist nicht gern allein, und auch seine Gene sind auf Zweisamkeit angelegt. Zusammen ist man stärker und auch die beiden Ausführungen eines Gens – je eines von Vater und Mutter – brauchen einander. Wissenschaftler am Max-Planck-Institut für molekulare Genetik in Berlin haben das Erbgut mehrerer hundert Menschen analysiert und die Erbinformation auf beiden Chromosomensätzen getrennt voneinander entschlüsselt. Allein in dieser verhältnismäßig kleinen Gruppe gibt es Millionen unterschiedlicher Genformen. Die Ergebnisse zeigen darüber hinaus, dass genetische Mutationen nicht zufällig auf den beiden elterlichen Chromosomensätzen vorkommen, sondern dass sie in jedem Menschen nach demselben Muster verteilt sind.
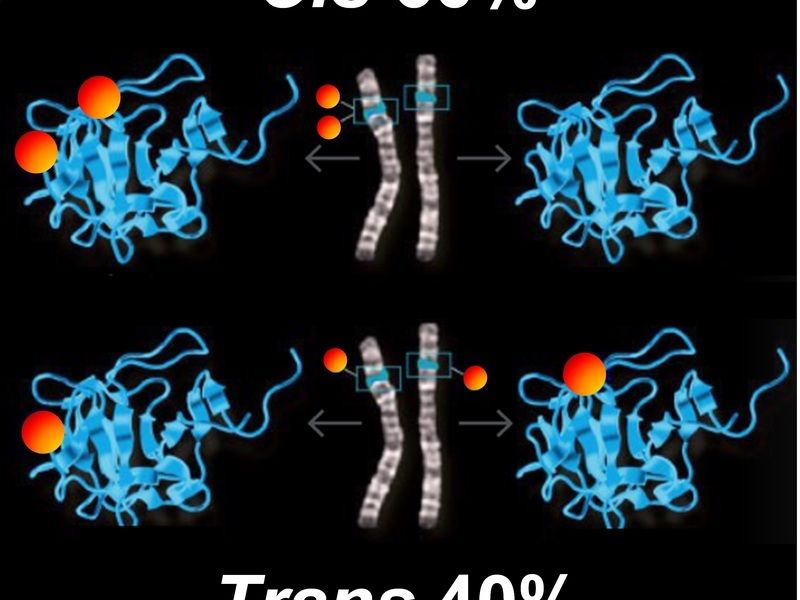
Jeder Mensch besitzt cis- und trans-Mutationen in einem 60:40-Verhältnis. In der cis-Konfiguration treten zwei Mutationen in ein und derselben Genkopie auf. Das zugehörige Protein wird dadurch außer Gefecht gesetzt, die zweite Kopie und deren Protein bleiben aber unbehelligt. In der trans-Konfiguration sind dagegen beide Genkopien mutiert und produzieren zwei geschädigte Proteine.
© Art 4 Science
Im Jahr 2001 gaben Wissenschaftler die Entschlüsselung des ersten Genoms eines Menschen bekannt. Inzwischen sind tausende weitere entziffert worden, der Preis für eine Erbgutanalyse wird bald die 1000-Dollar-Marke unterschreiten. Bei dieser rasanten Entwicklung vergisst man leicht, dass die eingesetzte Technik nur ein Mischprodukt der Erbinformation ausliest. Die heute gängigen Analyseverfahren berücksichtigen nämlich nicht, dass jeder Mensch zwei Varianten seines Erbguts besitzt. „Damit lassen sie eine wesentliche Eigenschaft des menschlichen Genoms unter den Tisch fallen. Es ist aber beispielsweise entscheidend zu wissen, wie Mutationen auf den Chromosomensätzen verteilt sind“, sagt Margret Hoehe vom Max-Planck-Institut für molekulare Genetik, die die Studie durchgeführt hat.
Hoehe und ihr Team haben molekulargenetische und bioinformatische Methoden entwickelt, mit denen sie die beiden Chromosomensätze eines Menschen getrennt sequenzieren können. Die Forscher haben die mütterlichen und väterlichen Anteile des Erbguts von 14 Personen entziffert und ihre Analysen mit dem Erbgut von 372 Europäern aus dem 1000-Genome-Projekt ergänzt. „14 Personen klingt nicht viel, aber angesichts der technischen Herausforderung eine weltweit bislang unerreichte Anzahl“, so Hoehe.
Die Ergebnisse zeigen, dass die meisten Gene in vielen unterschiedlichen Formen in einer Bevölkerung auftreten können: Im Durchschnitt gibt es von jedem Gen rund 250 verschiedene Formen. Alleine in den knapp 400 untersuchten Genomen ergibt das etwa vier Millionen unterschiedliche Genformen. Diese Zahl steigt weiter, je mehr Menschen untersucht werden. Dabei haben über 85 Prozent aller Gene keine Hauptform, die in mehr als der Hälfte aller Individuen vorkommt. Die ungeheure Vielfalt bringt es mit sich, dass über die Hälfte aller Gene eines Menschen, rund 9000 von 17500, so nur in dieser einen Person vorkommen – sie sind also im wahrsten Sinne individuell.
Das Gen, so wie wir es uns bisher vorgestellt haben, gibt es nur in Ausnahmefällen. „Wir müssen unsere Sicht auf die Gene, wie sie seit Gregor Mendel jedes Schulkind lernen muss, grundlegend überdenken. Auch reicht die herkömmliche Betrachtung von Einzelmutationen nicht mehr aus. Wir müssen stattdessen die beiden Genformen und deren jeweilige Kombinationen von Varianten berücksichtigen“, erklärt Hoehe. Bei Erbgutanalysen sollten Wissenschaftler also jede elterliche Genform individuell untersuchen, aber auch beide Formen in ihrer Wirkung als Paar.
Den Forschern zufolge sind Mutationen von Genen nicht zufällig zwischen den elterlichen Chromosomen verteilt. Sie betreffen zu 60 Prozent dieselbe Genform, zu 40 Prozent die andere – Wissenschaftler sprechen in diesem Zusammenhang von cis- und trans-Mutationen. Offenbar muss ein Organismus mehr cis-Mutationen aufweisen, bei denen die zweite Genform intakt bleibt. „Es ist erstaunlich, wie präzise das 60:40-Verhältnis eingehalten wird. Es tritt im Genom eines jeden Menschen auf – fast wie in einer magischen Formel“, sagt Hoehe. Der Verteilungsschlüssel von 60:40 scheint unverzichtbar für das Überleben zu sein. „Mit dieser Formel können wir möglicherweise verstehen, wie die Variabilität der Gene entsteht und wie sie deren Funktion beeinflusst.“
Ein Teil der vielen Varianten, die das Erbgut verändern, wirken sich auch auf Proteinebene aus. Die Forscher haben nun einen Satz von rund 4000 Genen identifiziert, der durch Mutationen so verändert wird, dass seine Proteine in menschlichen Organismen besonders häufig in zwei unterschiedlichen Formen vorliegen. Diese Gene kontrollieren vorrangig die Signalübertragung zwischen Zellen, das Immunsystem und die Regulation der Genaktivität. Diese Art der zweifachen Gen- und Proteinausstattung hat den Vorteil, dass die Aktivität der Gene flexibler reguliert und verändert werden kann. Durch Einsatz der jeweils vorteilhafteren Variante kann sich der Organismus besser an sich verändernde körpereigene Prozesse und Umweltbedingungen anpassen. Klappt die Zweisamkeit der Gene nicht und kommt die falsche Proteinform zum Einsatz, kann dies Krankheitsmechanismen in Gang setzen. Dies ist wahrscheinlich auch der Grund, warum unter diesen 4000 Genen viele Krankheitsgene sind.
Diese Erkenntnisse werden die Interpretation von Erbgut-Analysen und die Vorhersage von Krankheiten verändern. Auch die individualisierte Medizin darf nicht blind für die „Zweisamkeit“ menschlicher Genome sein. „Unsere Untersuchungen auf Proteinebene zeigen, dass 96 Prozent aller Gene ein Spektrum von mindestens fünf bis 20 unterschiedlichen Proteinformen haben. Dies ergibt eine ungeheure individuelle Vielfalt an möglichen Wechselwirkungen zwischen den Genen und zeigt, wie groß die Herausforderung ist, individuell maßgeschneiderte Therapien zu entwickeln“, sagt Hoehe.
Bisher haben Forscher das Krankheitsrisiko nur anhand der An- oder Abwesenheit von Mutationen geschätzt. Es gibt aber erste Hinweise darauf, dass beispielsweise bei Krebs die falsche Verteilung einer Mutation die Ausprägung und den Verlauf der Krankheit bestimmt. Die Lage von Mutationen muss deshalb künftig in die Diagnostik, Vorhersage und Vorsorge von Krankheiten einfließen.
Originalveröffentlichung
Margret R. Hoehe et al.; Multiple haplotype-resolved genomes reveal population patterns of gene and protein diplotypes; Nature Communications, 26. November 2014