Aufs Detail geschaut: Neue Einblicke in den Aufbau von HIV
Wie lagern sich die Strukturproteine des Aids-Erregers HIV zu einer vollständigen Virushülle zusammen? Der Antwort auf diese Frage sind Wissenschaftler des European Molecular Biology Laboratory (EMBL) und des Universitätsklinikums Heidelberg mit Hilfe der hochauflösenden Kryo-Elektronentomographie nun etwas näher gekommen. Sie bildeten das Proteingitter vollständiger, unreifer HI-Viren in einer so hohen, bisher nicht erreichten Auflösung ab, dass die einzelnen Bausteine und ihre Kontakte erstmals deutlich zu erkennen sind. Die neuen Erkenntnisse zur Architektur der Virushülle sind online in der Fachzeitschrift „Nature“ erschienen. „Je besser wir den Bildungs- und Reifungsprozess von HIV verstehen, desto eher können wir Schwachstellen ausfindig machen und als Angriffspunkte für Therapien nutzen“, sagt Professor Dr. Hans-Georg Kräusslich, Direktor des Zentrums für Infektiologie am Universitätsklinikum Heidelberg und einer der Autoren der Veröffentlichung.
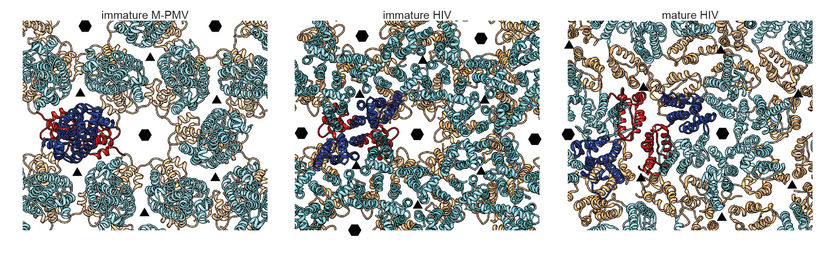
Die unreifen Formen des HI-Virus (Mitte) und des Mason-Pfizer Monkey Virus (links) unterscheiden sich. Bis das HI-Virus reif und damit infektiös wird, formt sich die Struktur nochmal um (rechts).
EMBL / F. Schur
Verflechtungen der Proteine anders als angenommen
Der Aufbau des Proteingitters überraschte die Experten: „Die Struktur ist anders als erwartet“, so Dr. John Briggs, Leiter der Forschungsgruppe am EMBL, in der diese Arbeiten durchführt wurden. Die Wissenschaftler gingen davon aus, dass die Hülle von HIV ähnlich aufgebaut sei wie die des ebenfalls von der Arbeitsgruppe um Briggs erforschten und mit HIV verwandten Mason-Pfizer Monkey Virus, da die Protein-Komponenten sich sehr ähneln. „Die unreifen Formen der Viren unterscheiden sich aber. Momentan wissen wir noch nicht, warum“, so Dr. Briggs.
Infizieren Humane Immundefizienz-Viren Zellen des menschlichen Immunsystems, so programmieren sie diese auf "Virusvermehrung" um: Dazu schleusen die HI-Viren ihr Erbgut mit allen notwendigen Informationen in den Zellkern ein. Von nun an vervielfältigen die Zellen das Erbgut des Aids-Erregers und produzieren Bausteine der Virushülle, wie das Eiweiß Gag. Noch innerhalb der Wirtszelle lagern sich die Gag-Proteine selbstständig zu einer kugelförmigen Gitterstruktur zusammen, die das Erbgut des Virus umschließt. Beim Verlassen der Zelle umgeben sich die neu gebildeten, noch unreifen Viren mit einem Teil der Zellhülle. Zuletzt wird das Gitter aus Gag-Proteinen nochmals umgebaut; erst nach dieser „Reifung“ sind die Viren infektiös.
Wie sich die einzelnen Gag-Proteine im Detail zur kugeligen Gitterstruktur einer intakten Virenhülle verbinden – ein entscheidender Prozess für die Ausbreitung der Infektion im Körper –, untersuchen die Heidelberger Wissenschaftler bereits seit den 1990er Jahren mittels der Kryo-Elektronenmikroskopie. Die Viren, aufgereinigt und unschädlich gemacht, stammen aus dem Labor von Professor Kräusslich, der mit seinem Team die Mechanismen der HIV-Vermehrung und -Ausbreitung erforscht. Die Arbeitsgruppen Briggs und Kräusslich kooperieren bereits seit längerem erfolgreich im Rahmen der Molecular Medicine Partnership Unit (MMPU) zwischen EMBL und Universitätsklinikum. 2009 ging aus dieser Zusammenarbeit das erste dreidimensionale Computermodell unreifer HIV-Partikel im Nanometerbereich hervor, das die Gitterstruktur der Viren auf Proteinebene zeigte und erklärte, wie aus der ursprünglich flachen Wabenstruktur der Gag-Proteinen die kugelige Virenhülle entstehen kann.
Blick auf molekulare Ebene erleichtert Suche nach Schwachstellen
Inzwischen haben sich Mikroskopietechnik und Datenanalyse weiter entwickelt und erlauben den Blick auf immer kleinere Details. „Dieser Ansatz eröffnet uns viele neue Möglichkeiten“, sagt Erstautor Florian Schur, Doktorand bei John Briggs. So lassen sich in Zukunft nicht nur verschiedene Viren, sondern auch die molekularen Wirkmechanismen von Virus-Hemmstoffen sowie Zielstrukturen für neue Medikamente besser untersuchen. „Einer der nächsten Schritte wird es sein, die Kontaktstellen der Gag-Proteine innerhalb des Gitters genauer unter die Lupe zu nehmen und z.B. herauszufinden, wie man diese unterbrechen und damit die Vermehrung des Virus in den Zellen stören kann“, so Kräusslich.
Molekulare Einblicke sind in dieser Form nur mit der Kryo-Elektronentomographie möglich: Durch das blitzartige Einfrieren auf minus 196 Grad Celsius bleibt die räumliche Struktur und Anordnung der Virusbestandteile erhalten. Im Elektronenmikroskop wird das Objekt aus verschiedenen Richtungen durchstrahlt. Die Aufnahmen aus verschiedenen Blickwinkeln ergeben zusammen ein dreidimensionales Struktur-Modell mit einer Auflösung von weniger als einem Nanometer, also einem Millionstel Millimeter.




















































