Ein Molekül auf der optischen Flüstergalerie
Mit einer Mikrokugel und einem Nanodrähtchen lassen sich einzelne unmarkierte Biomoleküle durch Licht nachweisen
Einzelne Biomoleküle aufzuspüren und sie bei der Arbeit zu beobachten – das ist ein Traum von Biochemikern. Denn auf diese Weise könnten sie die Arbeitsweise der Nanomaschinen des Lebens, wie etwa der Ribosomen oder der DNA-Polymerasen, detailliert untersuchen und besser verstehen. Diesem Ziel sind Forscher des Max-Planck-Institutes für die Physik des Lichtes nun einen wesentlichen Schritt nähergekommen. Mit einer optischen Mikrostruktur und Nanopartikeln aus Gold haben sie die Wechselwirkung von Licht mit dem Erbgutmolekül DNA so weit verstärkt, dass sie die Interaktion zwischen einzelnen DNA-Molekülteilen verfolgen können. Sie gingen damit an die Grenze des physikalisch Möglichen. Ihr optischer Biosensor für einzelne, unmarkierte Moleküle könnte auch für Biochips relevant sein: fingernagelgroße Mini-Labore, die einen Tropfen Blut in mobilen Analysegeräten schnell auf mehrere Krankheiten gleichzeitig testen oder mit wenig Probenmaterial umfassende Umweltanalysen ermöglichen.
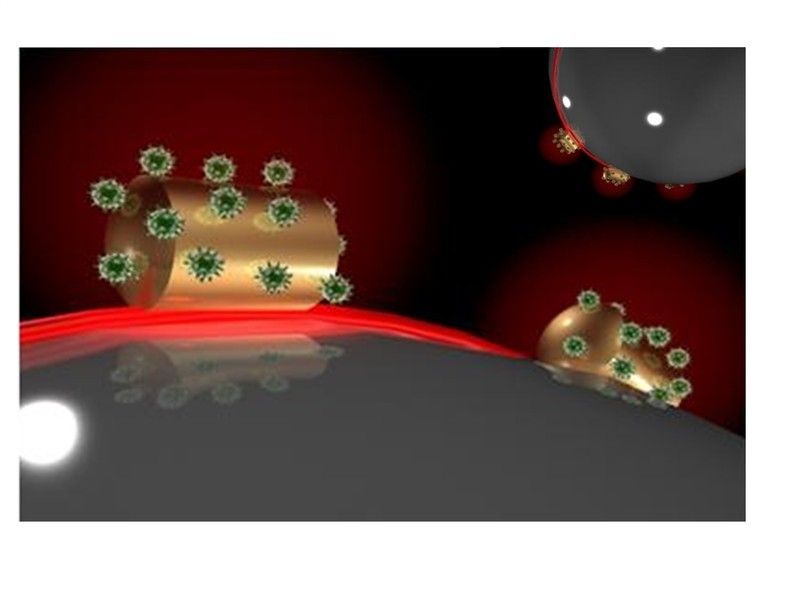
Max-Planck-Forscher um Frank Vollmer versehen Mikrokugeln mit goldenen Nanodrähten, an denen Moleküle binden können. Diese lassen sich nachweisen, da sich die Wellenlänge des Lichts verschiebt, das durch die Mikrokugel und ein Nanodrähtchen verstärkt wird.
© MPI für die Physik des Lichts
Zu wissen, wie einzelne Biomoleküle miteinander interagieren, ermöglicht erst das Verständnis grundlegender Lebensprozesse. In den Zellen fügen Nanomaschinen wie etwa Ribosomen und DNA-Polymerasen einzelne Moleküle zu komplexen biologischen Strukturen wie Proteinen beziehungsweise DNA-Molekülen zusammen, in denen Erbinformation gespeichert ist. Zwar lässt sich die Interaktion einzelner Moleküle mit Enzymen oder Ribosomen durchaus untersuchen. Doch dafür müssen die Moleküle oft zum Beispiel mit Leuchtstoffen markiert werden, um sie beobachten zu können. Doch diese Markierung ist nur bei bestimmten Molekülen möglich und kann die Funktion der biologischen Nanomaschinen einschränken. Biomoleküle lassen sich zwar auch ohne Markierung mit Licht nachweisen. Dabei können aber keine einzelnen DNA-Moleküle detektiert werden, weil die Wechselwirkung der Lichtwellen mit den Molekülen dafür zu schwach ist.
Physiker um Frank Vollmer vom Labor für Nanophotonik und Biosensorik am Max-Planck-Institut für die Physik des Lichtes ist es nun gelungen, die Wechselwirkung von Licht mit DNA-Molekülen so weit zu verstärken, dass sie mit ihrem photonischen Biosensor einzelne, unmarkierte Moleküle und deren Interaktionen untereinander beobachten können.
Eine Mikrokugel wird zur optischen Flüstergalerie
Dazu nutzen sie Glaskügelchen von rund 60 Mikrometern Durchmesser, was etwa der Dicke eines Haares entspricht, und Nanodrähtchen aus Gold von etwa 12 Nanometern Durchmesser und 42 Nanometern Länge. Das Golddrähtchen ist also nur etwa ein 10000stel so dick wie ein Haar. Mikrokugel und Nanodrähtchen verstärken die Wechselwirkung zwischen Licht und Molekülen. Mittels eines Prismas koppelten die Forscher Laserlicht in die Mikrokugel ein. Das Licht wird immer wieder an der Innenseite der Kugeloberfläche reflektiert, sodass es letztlich an dessen Innenseite entlangläuft, ähnlich wie Schallwellen, die sich entlang der Wände von manchen runden Räumen ausbreiten: Flüstert eine Person an einer Seite des Gewölbes, kann sie eine andere Person an der gegenüberliegenden Seite verstehen, auch wenn sie dafür eigentlich zu weit entfernt steht. Denn die Schallwellen verlieren nicht an Intensität, während sie sich ausbreiten.
Wenn ein Molekül an der Oberfläche des Glaskügelchens gebunden ist, kommt der Lichtstrahl mehr als hunderttausend Mal an ihm vorbei. Da die Lichtwelle stets etwas aus der Mikrokugel herauslappt, kommt es zwischen ihr und dem Molekül zur Wechselwirkung, die durch den häufigen Kontakt zwischen Licht und Molekül deutlich verstärkt. Doch die Wechselwirkung ist immer noch zu schwach, um einzelne Moleküle zu registrieren.
Daher bringen Vollmer und seine Kollegen Nanodrähtchen auf der Oberfläche der Glaskügelchen an. In ihnen erzeugt das vorbeikommende Licht so genannte Plasmonen: kollektive Schwingungen von Elektronen. „Die Plasmonen ziehen die Lichtwelle etwas weiter aus der Glaskugel heraus“, erklärt Vollmer. Dadurch verstärke sich die Feldstärke der Lichtwelle um mehr als den Faktor 1000. Insgesamt reicht die Verstärkung des Detektors nun aus, um einzelne Biomoleküle wie etwa DNA-Fragmente nachzuweisen. Und das haben die Erlanger Forscher auch getan. Zu diesem Zweck befestigten sie an dem Nanodrähtchen auf einem Mikrokügelchen den Teilstrang eines DNA-Moleküls, das im Zellkern stets als Doppelstrang vorliegt. Bindet nun der dazu passende, also komplementäre DNA-Teilstrang an den Köder auf dem Nanodrähtchen, so verschiebt sich die Wellenlänge des Lichts, das durch die Mikrokugel und das Nanodrähtchen verstärkt wird. Diese Verschiebung lässt sich messen.
Verschiedene Teilstränge lassen sich durch ihr Bindungsverhalten unterscheiden
Die Physiker verwendeten allerdings einen kürzeren Teilstrang, als dies bei ähnlichen Verfahren üblich ist. Kürzere DNA-Fragmente haften wie ein kurzer Klebestreifen an einer Wand schlechter aneinander, sodass sich die Stränge relativ schnell wieder trennen. So können immer wieder neue Teilstränge an dem molekularen Köder binden, und zwar auch solche, die nicht vollkommen zu ihm passen. So lässt sich erforschen, wie lange die Teilstränge miteinander wechselwirken und wie oft der Köder einen Teilstrang einfängt. „Dieser Ansatz ermöglicht es, einen einzelnen DNA-Rezeptor zu benutzen und dessen sukzessive Interaktionen mit verschiedenen Teilsträngen in der Probenlösung zu verfolgen“, sagt Frank Vollmer. „Anhand der Dauer und Häufigkeit der gemessenen Interaktionen lassen sich dann verschiedene unmarkierte DNA-Moleküle spezifisch nachweisen.“
Die Forscher testeten ihren optischen Biosensor mit einer Probe, die sowohl einen exakt passenden DNA-Teilstrang als auch ein Fragment enthielt, das nicht ganz so gut passte. Anhand der unterschiedlichen Reaktionskinetik der beiden Teilstränge konnten die Forscher diese unterscheiden.
Auch in der Natur sind die Bindungen zwischen Nanomaschinen und Molekülen vorübergehend. Diese natürliche Kinetik lasse sich durch die neue Methode der Erlanger Forscher nun besser erforschen lasse, sagt Frank Vollmer „Da gibt es sehr viel Forschungsbedarf“, freut sich der Physiker auf die künftigen Aufgaben.
Die Erlanger planen nun entsprechende Forschungsprojekte. „Es lässt sich beispielsweise beobachten, wie ein Enzym wie etwa die DNA-Polymerase Stoffe umwandelt“, erklärt Vollmer. Zudem wollen die Wissenschaftler ihren photonischen Biodetektor in optische Mikrochips integrieren, um sie in der klinischen Diagnostik zur Anwendung zu bringen.