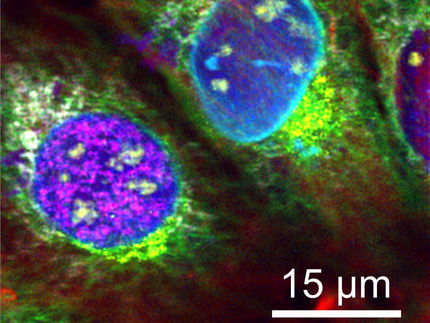
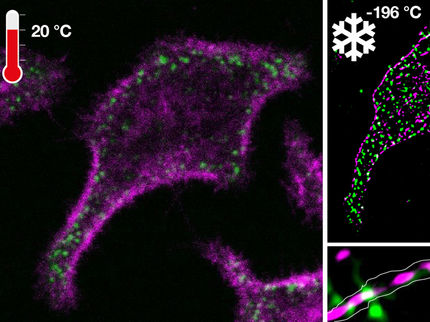
Nanokosmos der Zellen unter der Lupe
Wissenschaftlern der Universität Würzburg ist mit einer neuen Technik ein bislang einmaliger Blick auf Membranen menschlicher Zellen gelungen. Die von ihnen entwickelte Technik macht einzelne verzuckerte Proteine und Lipide mit molekularer Auflösung sichtbar.

Wie ein Satellit, der unglaublich scharfe Fotos von der Erdoberfläche liefert: So ähnlich funktioniert die mikroskopische Technik dSTORM mit den leuchtenden Zuckern.
AK Jürgen Seibel / AK Markus Sauer
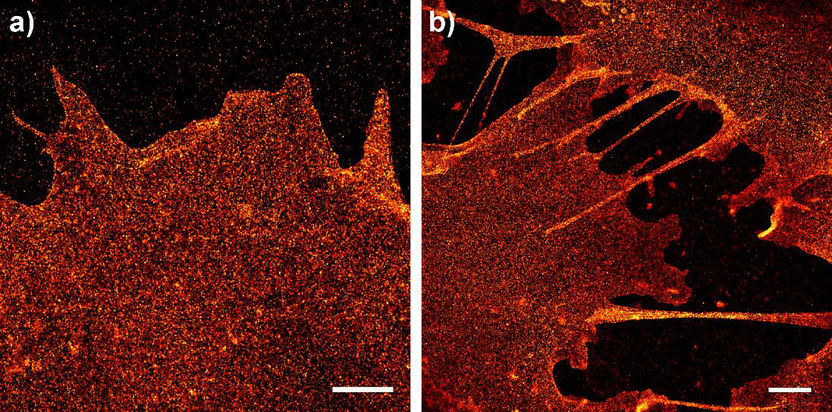
Diese dSTORM-Abbildung zeigt die Glycocalix der Plasmamembran von Zellen mit der homogenen Verteilung verzuckerter Proteine und Lipide.
AK Markus Sauer

Man kann es sich wie einen um die Erde kreisenden Satelliten vorstellen, der in eindrucksvoller Schärfe viele Einzelbilder vom nächtlichen Planeten aufnimmt, die – zu einer einzigen großen Aufnahme zusammengesetzt – ein extrem detailreiches Abbild des Nachtlebens auf der Erdoberfläche liefern. Nur dass in diesem Fall die Kamera nicht um die Erde kreist, sondern über menschlichen Zellen. Und dass das Licht, das sie aufnimmt, nicht von Laternen, Autoscheinwerfern und Lampen stammt, sondern von speziellen Strukturen innerhalb der Zellmembran – genauer gesagt: von Glycoproteinen und Lipiden, die mit einer besonderen Technik zum Leuchten gebracht wurden.
Verantwortlich für diese Bilder sind der Biophysiker Professor Markus Sauer und der Chemiker Professor Jürgen Seibel von der Universität Würzburg. Über ihre neuen Erkenntnisse berichten die beiden in der renommierten Fachzeitschrift „Angewandte Chemie“. Deren Herausgeber haben den Artikel sogar als „hot paper“ eingestuft: Dieses Prädikat bekommen nur Arbeiten, denen man eine sehr große wissenschaftliche Bedeutung beimisst.
Veränderte Zuckermoleküle und leuchtende Farbstoffe
„Wir haben Zucker-analoge Strukturen chemisch hergestellt und zu der Nährlösung der menschlichen Zellen gegeben“, erläutert Jürgen Seibel die Vorgehensweise der Chemiker. Die Zellen haben diese Moleküle verstoffwechselt und biosynthetisch auf ihrer Zelloberfläche in ihre Membran eingebaut. Der Trick dabei: „Wir haben die Zuckermoleküle leicht verändert, so dass sie mit einem fluoreszierenden Farbstoff verbunden werden können“, sagt Seibel.
Aufgabe der Biophysiker war es anschließend, diese Farbstoffe auf eine geeignete Art und Weise zum Leuchten zu bringen, um so ein Abbild der einzelnen Moleküle auf der Zellmembran zu erzeugen. Die Technik, die dabei zum Einsatz kam, hat Markus Sauer mit seiner Arbeitsgruppe entwickelt. Ihr Name: dSTORM – direct Stochastic Optical Reconstruction Microscopy. Dabei handelt es sich um eine spezielle Form einer hochaufgelösten Fluoreszenzmikroskopie; sie macht es möglich, zelluläre Strukturen und Moleküle mit zehnfach verbesserter Auflösung abzubilden. Die Größenordnung der dargestellten Objekte liegt dabei zwischen 20 und 30 Nanometern – also millionsten Teilen von Millimetern.
Ein Aus-Schalter stoppt die Fluoreszenz
„Bei der dSTORM-Mikroskopie werden kommerzielle Fluoreszenzfarbstoffe verwendet, die bei Bestrahlung mit Licht geeigneter Wellenlänge in Gegenwart von Thiolen in einen reduzierten, sehr stabilen optischen ‚Aus‘-Zustand übergehen“, erklärt Markus Sauer das Prinzip dieser Technik. Anders ausgedrückt: Die Farbstoffe fluoreszieren für einige Sekunden nicht mehr.
Was beim ersten Anhören merkwürdig klingt – Farbstoffe werden abgeschaltet, damit ein hoch aufgelöstes Bild erzeugt werden kann – erweist sich als sinnvoll, wenn man die weiteren Details kennt: „Nach der Bestrahlung der Zelle gehen mehr als 99,9 Prozent der Farbstoffe schnell wieder aus. Aber einige wenige leuchten noch“, sagt der Biophysiker. Deren Signale können die Wissenschaftler räumlich getrennt detektieren und so die exakte Position des Farbstoffs berechnen. Es ist also möglich, einzelne Farbstoffmoleküle zu lokalisieren. Anschließend verfallen auch diese Moleküle in den inaktiven Aus-Zustand.
Das Gesamtbild kommt dann zustande, wenn die Wissenschaftler diesen Vorgang viele Male wiederholen und viele „Einzelbilder“ anschließend zusammenpuzzeln. „Nach der stochastischen Zufallsregel werden alle Farbstoffe in den fluoreszierenden „An-Zustand“ überführt und einzeln lokalisiert“, sagt Sauer. Ein fertiges Bild ist dann entstanden, wenn alle Moleküle ihr Signal abgegeben haben.
Genaue Aussagen über Ort und Menge
Bis zu 1600 Glycoproteine und Glycolipide pro Quadratmikrometer haben die beiden Wissenschaftler mit dieser Methode auf der Oberfläche menschlicher Zellen gezählt. Insgesamt trägt eine einzelne Zelle somit rund fünf Millionen dieser Bausteine. Aus etwa einer Billion Zellen besteht der Mensch.
Die an der Universität Würzburg durchgeführten Untersuchungen erlauben erstmals die exakte Ortung und Quantifizierung der Anzahl von Zuckern auf Zelloberflächen. Dies ist von besonderem Interesse bei der Erforschung von Infektionskrankheiten und Krebs, erklärt Jürgen Seibel. Denn kohlenhydrathaltige Makromoleküle, sogenannte Glycoproteine und Glycolipide, steuern auf der Zelloberfläche Immunantworten, Zellwachstum und Zellsterben. Tumore und Bakterien, aber auch Viren imitieren und nutzen den natürlichen Erkennungsprozess und infizieren die menschlichen Zellen. Die Würzburger Wissenschaftler erhoffen sich von ihrer neuen Methode tiefere Einblicke in solche biologischen Ereignisse. Ihre Arbeiten liefen im Rahmen des Verbundprojektes „3D-Super-Resolution“, das vom Bundesforschungsministerium gefördert wird.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.

Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.