Wie das Herz aus dem Takt gerät
Wenn der Türsteher versagt: Überaktive Kaliumkanäle führen zu lebensbedrohlichen Herzrhythmusstörungen. Das haben Mediziner aus Marburg und Münster herausgefunden, die ein neues Gen entdeckten, das die elektrische Reizleitung im Herzen beeinflusst. Die Wissenschaftler veröffentlichen ihre Ergebnisse vorab online bei der Fachzeitschrift „EMBO Molecular Medicine“.
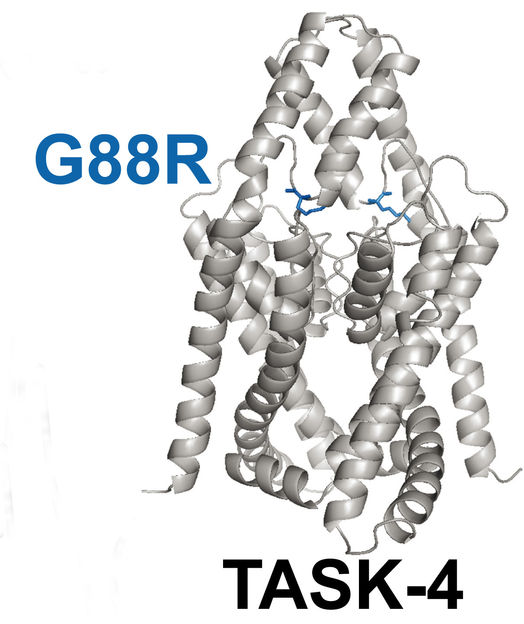
Wie das Strukturmodell zeigt, befindet sich an Position 88 des Kanalproteins TASK-4 fälschlicherweise die Aminosäure Arginin (blau), die eine veränderte Funktion des Kaliumkanals bewirkt.
Abbildung: Autoren
Unser Herz pumpt in einem Rhythmus, den elektrische Signale vorgeben. Diese Signale werden in spezialisierten Herzmuskelzellen erzeugt und weitergeleitet. Ist die Reizleitung gestört, so kommt es zu Beschwerden wie einem langsamen Herzrhythmus, die eine Implantation von künstlichen Herzschrittmachern erforderlich machen.
Die Wissenschaftler beschäftigte der besonders ungewöhnliche Fall eines Patienten, der an einer schweren Form von Reizleitungsstörung leidet und zudem von Kammerflimmern betroffen ist, der bedrohlichsten Herzrhythmusstörung. „Welche Gene an diesen Krankheiten beteiligt sind, ist weitestgehend unbekannt“, sagt der Physiologe Professor Dr. Niels Decher von der Philipps-Universität, der die Studie zusammen mit seinem Kollegen Professor Dr. Eric Schulze-Bahr vom Universitätsklinikum Münster leitete.
Um den Ursachen der Erkrankung auf die Spur zu kommen, untersuchte die Gruppe aus Münster das Erbgut des Patienten – etwa 22.000 Gene. „So etwas nahm um die Jahrtausendwende, als man das menschliche Genom entschlüsselte, noch Jahre in Anspruch“, erläutert Decher. „Dank neuer Techniken geht das heute innerhalb weniger Wochen.“
Überraschenderweise fanden die Wissenschaftler bei dem Betroffenen zwei krankhaft veränderte Gene, darunter die Bauanleitung für einen Kaliumkanal. „Der vorliegende Fall beruht nicht auf einer einzelnen Genveränderung, sondern ist eher die Folge mehrerer mutierter Gene, die zusammenwirken“, erklärt Schulze-Bahr; „er zeigt, dass bei besonderen Krankheitsfällen ein einziger Befund nicht ausreichend die Schwere erklären kann.“
Die Erregbarkeit von Herzmuskelzellen setzt voraus, dass sich in ihrem Inneren andere elektrisch geladene Teilchen befinden als außerhalb; dadurch baut sich eine elektrische Spannung über den Membranen auf, die jede Zelle umhüllen. Die geladenen Teilchen können durch Kanäle von einer Seite auf die andere gelangen, etwa durch spezielle Kaliumkanäle. Wie das Autorenteam feststellte, führt die Mutation des Kaliumkanals „TASK-4“ dazu, dass dessen Leitfähigkeit für Ionen sich dreifach erhöht. Dadurch verlangsamt sich die Selbsterregung der betroffenen Zellen stark, weil der Unterschied zwischen Membranoberfläche und Zellinnerem nicht mehr groß genug ist.
Die fehlerhafte Genvariante setzt sich selbst dann durch, wenn das betroffene Gen in derselben Zelle auch noch in unverändertem, funktionsfähigem Zustand vorkommt. „Unsere Studie beschreibt erstmals, dass Kaliumkanäle vom K2P-Typ an vererbten Herzrhythmusstörungen beteiligt sind“, betonen die Verfasser.
Niels Decher lehrt Vegetative Physiologie an der Philipps-Universität. Eric Schulze-Bahr ist Direktor des Institutes für Genetik von Herzerkrankungen am Universitätsklinikum Münster. Beide sind Mitglieder einer überregionalen Forschergruppe (FOR 1086) der Deutschen Forschungsgemeinschaft zum Thema "K2P-Kanäle – vom Molekül zur Physiologie und Pathophysiologie". Die Studie wurde außerdem unter anderem von der Anneliese-Pohl-Stiftung finanziell gefördert.