Krebsprotein unterwegs zur Zellmembran
KRas pendelt zwischen verschiedenen Membranen innerhalb der Zelle, damit es in ausreichender Menge an seinem eigentlichen Bestimmungsort vorhanden ist
Das Krebsprotein KRas ist an der Entstehung verschiedener Krebsformen beteiligt. Mutiertes KRas findet sich beispielsweise in einem Großteil aller Tumorzellen von Bauchspeicheldrüsenkrebs-Patienten. Es sitzt an der Innenseite der Zellmembran und leitet dort Signale in das Innere der Zelle weiter. Wissenschaftler vom Max-Planck-Institut für molekulare Physiologie in Dortmund haben nun herausgefunden, weshalb KRas unter dem Mikroskop fast ausschließlich an der Zellmembran beobachtet wird. Demnach wird das Protein nach seiner Bildung nicht gezielt zur Zellmembran geschickt, sondern es befindet sich während seiner gesamten Lebenszeit auch auf anderen Membransystemen innerhalb der Zelle. Damit es von speziellen Transportvesikeln aus der Nähe des Zellkerns zur Zellmembran gebracht werden kann, müssen der Löslichkeitsfaktor PDEδ und sein Gegenspieler Arl2 aktiv werden. Ohne die beiden würde sich KRas auf alle Membranen der Zelle verteilen. Mit ihren Ergebnissen können die Forscher die Wirkungsweise des von ihnen entwickelten potenziellen Anti-Krebswirkstoffs Deltarasin noch besser verstehen.
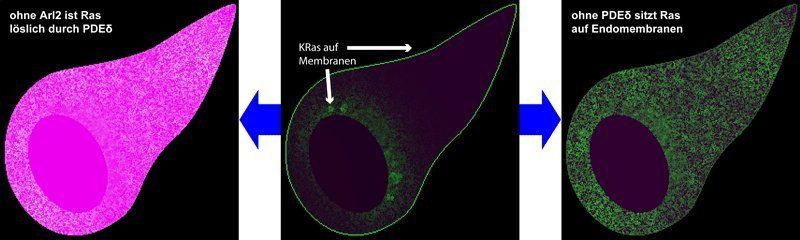
Die Verteilung des Krebsproteins KRas in einer Zelle.
© M. Schmick
Das Protein KRas agiert als molekularer Schalter bei der Weiterleitung von Signalen in das Innere der Zelle, die unter anderem das Zellwachstum steuern. Damit KRas richtig funktionieren kann, muss es ausreichend lange an der Innenseite der Zellmembran bleiben. Dabei hilft ihm sein wasserunlöslicher Fettanker. Dieser würde das Protein allerdings auch in anderen intrazellulären Membranen verankern. Deshalb besitzt KRas einen Bereich positiver Ladungen in der Nähe des Fettankers. Dieser kann – ähnlich einer Styroporkugel in einer Plastiktüte – über elektrostatische Wechselwirkung mit der negativ geladenen Innenseite der Zellmembran eine stabilere Verbindung eingehen.
Aber selbst Fettanker und positive Ladungen reichen nicht aus, um KRas dauerhaft an der Zellmembran anzureichern. Den Ergebnissen der Dortmunder Forscher zufolge würden nämlich trotzdem viele KRas-Moleküle auf der im Vergleich zur Zellmembran 200-mal größeren Oberfläche der übrigen in der Zelle vorhandenen Membransysteme verloren gehen. Mithilfe aufwändiger Computersimulationen haben die Wissenschaftler Daten aus Fluoreszenzmikroskopie-Experimenten ausgewertet und die Bewegung von KRas auf seiner Reise durch die Zelle nachvollzogen. „Unsere Ergebnisse zeigen, dass die Zellmembran keineswegs das eindeutige Ziel von KRas ist, das nur einmal getroffen werden muss. Stattdessen verteilt sich KRas ständig relativ unspezifisch auf die verschiedenen Membransysteme der Zelle und muss dann über einen kontinuierlichen Kreislauf auf der Innenseite der Zellmembran konzentriert werden“, erklärt Malte Schmick vom Max-Planck-Institut für molekulare Physiologie.
Als ersten Schritt dieses Zyklus umschließt das lösliche Protein PDEδ den Fettanker von KRas wie einen Handschuh und macht KRas damit wasserlöslich. Dadurch wird verhindert, dass es irgendeine willkürliche Membran findet. KRas kann so in der Zellflüssigkeit schwimmend die Zelle erkunden. Gelangt es in die Nähe des Zellkerns, wird dieser Handschuh vom dort aktiven Protein Arl2 wieder abgestreift. Nun ist KRas wieder wasserunlöslich und kann eingefangen und von speziellen Membran-umhüllten Bläschen zur Zellmembran gebracht werden.
Die Zelle hat also kein eindeutiges Adresssystem für KRas, mit dem sie es ausschließlich in die Zellmembran schicken kann. Stattdessen wird das Protein weit gestreut und durch wiederholtes Umsortieren aus den falschen in die richtige Membran geschickt. „Jedes KRas-Molekül lebt mehrere Stunden bevor es in der Zelle wieder abgebaut wird. Nach sieben Minuten gelangt die Hälfte aller KRas-Moleküle von der Zellmembran wieder ins Innere der Zelle, wo sie wieder in den Zyklus eingespeist und zurück zur Zellmembran geschickt werden. Insgesamt ist jedes KRas-Molekül etwa 20 Minuten unterwegs bevor es wieder an der Zellmembran ankommt“, sagt Schmick.
Die Ergebnisse der Dortmunder Wissenschaftler könnten die Grundlage für die Entwicklung neuer Krebsmedikamente sein. Denn bei vielen Krebsformen ist KRas so verändert, dass es dauerhaft aktiv ist und die Zelle es nicht mehr ausschalten kann. Jeder dritte Tumor enthält Zellen mit mutierten Varianten von Ras-Proteinen. So verhindert beispielsweise mutiertes KRas bei Darmkrebs eine erfolgreiche Therapie mit Antikörpern gegen sogenannte epidermale Wachstumsfaktorrezeptoren (EGFR).
„Wir können nun weitere Wirkstoffe entwickeln, die die Anreicherung von mutiertem, dauerhaft aktivem KRas an der Zellmembran reduzieren“, erklärt Philippe Bastiaens, Direktor am Max-Planck-Institut in Dortmund. So ist es ihm und seinen Kollegen Herbert Waldmann und Alfred Wittinghofer 2013 gelungen, einen Hemmstoff gegen PDEδ namens Deltarasin zu entwickeln.Erste Versuche an Mäusen haben gezeigt, dass dieser Wirkstoff das Tumorwachstum stark verlangsamt. Auch wenn die Relevanz von PDEδ schon länger bekannt war, ist nun erstmals der Mechanismus erklärt, mit welchem Deltarasin unterbindet, dass sich KRas an der Zellmembran anreichert und bewirkt, dass es sich überall in der Zelle verteilt.
Originalveröffentlichung
Malte Schmick, Nachiket Vartak, Björn Papke, Marija Kovacevic, Dina C. Truxius, Lisaweta Rossmannek, Philippe I.H. Bastiaens; KRas localizes to the plasma membrane by spatial cycles of solubilization, trapping and vesicular transport; Cell, 10 April 2014
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.

Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.