Der tausend Tröpfchen Test
Chemische Reaktionen in zellähnlichen Systemen liefern überraschende Vielfalt
In einem winzigen Tröpfchen könnte in Zukunft ein ganzes Chemie-Labor Platz finden. Eine Gruppe von Wissenschaftlern des Exzellenzclusters Nanosystems Initiative Munich (NIM) ist es gelungen, in einem einfachen Modell einer künstlichen Zelle erstmals ein komplexes biochemisches System zu etablieren und zu untersuchen. Dabei entdeckten sie eine überraschende Vielfalt.

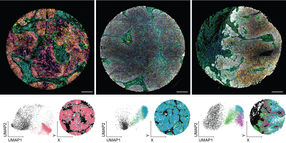
Mikrometer kleine Tröpfchen einer Emulsion bilden die Reaktionsgefäße für eine komplexe, oszillierende Reaktion.
Maximilian Weitz / TUM
In einer biologischen Zelle laufen schier unendlich viele komplexe und miteinander verknüpfte Reaktionen ab. Um solche Netzwerke besser untersuchen zu können, versuchen Wissenschaftler um Professor Friedrich Simmel, Inhaber des Lehrstuhls für Bioelektronik der Technischen Universität München (TUM), sie mit den nötigen Komponenten in einer Art künstlichen Zelle nachzubauen. Dahinter steht zudem die Überlegung, solche Ein-Zell-Systeme in Zukunft beispielsweise als „Nanofabriken“ für die Herstellung komplizierter organischer Substanzen oder Biomaterialien zu nutzen.
Bisher funktionierten solche Versuche allerdings überwiegend nur mit sehr einfachen Reaktionen. Das Team um Professor Friedrich Simmel hat jetzt erstmals eine komplexere biochemische Reaktion in nur wenige Mikrometer kleinen Tröpfchen untersucht. Gemeinsam mit Kooperationspartnern von der University of California Riverside und vom California Institute of Technology in Pasadena, USA, präsentieren die Wissenschaftler ihre Ergebnisse in der aktuellen Ausgabe von Nature Chemistry.
Mit einmal Schütteln – tausend Experimente
Für das Experiment gaben sie eine wässrige Reaktionslösung in Öl und schüttelten den Ansatz kräftig, so dass eine Emulsion mit Tausenden kleiner Tröpfchen entstand. Mit winzigen Mengen Material können sie so günstig und schnell eine extrem große Zahl paralleler Versuche gleichzeitig ansetzen.
Als Testsystem wählten die Forscher einen sogenannten biochemischen Oszillator. Dabei handelt es sich um mehrere Reaktionen mit DNA und RNA, die periodisch immer wieder hintereinander ablaufen. Ihr Rhythmus wird dadurch erkennbar, dass sich in einem Schritt zwei DNA-Stränge so aneinander lagern, dass ein Fluoreszenzfarbstoff leuchtet. Dieses gleichmäßige Blinken zeichnen die Wissenschaftler mit einer speziellen Kamera auf.
Kleine Tropfen – große Unterschiede
Mit ihrer Arbeit wollten Friedrich Simmel und seine Kollegen zunächst grundsätzlich untersuchen, wie sich ein komplexes Reaktionssystem verhält, wenn es auf Zellgröße herunterskaliert wird. Konkret stellten sie zudem die Frage, ob sich alle Tropfen-Systeme gleich verhalten und wodurch mögliche Unterschiede verursacht werden.
Ihre Versuche zeigten, dass die Oszillationen in den einzelnen Tröpfchen stark voneinander abwichen, und zwar stärker, als dies nach einem einfachen statistischen Modell zu erwarten gewesen wäre. Deutlich wurde vor allem, dass kleine Tropfen sich stärker unterschieden als große. „Es ist zunächst überraschend, in einem noch vergleichsweise einfachen chemischen System ähnliche Variabilität und Individualität zu beobachten, wie man dies sonst eher von biologischen Zellen her kennt“, erläutert Friedrich Simmel die Ergebnisse.
Exakt gleiche Systeme lassen sich so derzeit also nicht realisieren. Für die Praxis bedeutet das, entweder nach Möglichkeiten zu suchen, um diese Schwankungen zu korrigieren oder sie von vornherein mit einzukalkulieren. Darüber hinaus lassen sich die vielen leicht unterschiedlichen Systeme auch gezielt dazu nutzen, aus Tausenden von Ansätzen einen optimal laufenden herauszusuchen.
Die Forschung an komplexen biosynthetischen Systemen in künstlichen Zellen hält eine Menge weiterer Fragen bereit. Friedrich Simmel möchte sich in einem der nächsten Schritte den theoretischen Modellen dahinter widmen: „Es ist uns mit dieser Arbeit gelungen, über die hochparallele Aufnahme der Emulsionströpfchen zahlreiche interessante Daten zu gewinnen. Unser Ziel ist es nun, mit deren Hilfe die theoretischen Modelle von biochemischen Reaktionsnetzwerken bei kleinen Molekülzahlen zu überprüfen und zu verbessern.“