Störfunk im Tumor
Wie ein Immunmolekül Krebszellen verhungern lässt
Das Eiweißmolekül Interferon-beta (IFN-β) hat in seinem Namen die gleichen lateinischen Wurzeln wie das englische Wort „interfere“, zu Deutsch „einmischen“. Genau das tut der Signalstoff, der bei Infektionen und Krebserkrankungen vermehrt gebildet und teilweise therapeutisch verabreicht wird. Er verhindert unter anderem, dass in einem Tumor neue Blutgefäße entstehen und hemmt so dessen Wachstum. Wissenschaftler des Helmholtz-Zentrums für Infektionsforschung (HZI) haben jetzt herausgefunden, dass IFN-β dazu die Kommunikation zwischen Immunzellen und Krebsgewebe behindert. Ihre Erkenntnisse, veröffentlicht in der Fachzeitschrift „International Journal of Cancer“, helfen zu verstehen, wie sich dieser „Störfunk“ therapeutisch nutzen lässt.
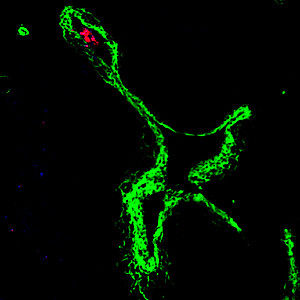
Fluoreszenzaufnahme eines neutrophilen Granulozyten (in rot), der aus einem Blutgefäß (in grün) in einen Tumor wandert. Diese Immunzellen unterstützen das Wachstum der Blutgefäße im Tumor und verbinden ihn so mit der lebenswichtigen Blutversorgung.
© HZI/Jablonska-Koch
Genau wie gesunde Zellen benötigen auch Tumorzellen Nährstoffe und Sauerstoff, um zu überleben. Deshalb muss ein Tumor ab einer bestimmten Größe dafür sorgen, dass er an den Blutkreislauf angeschlossen wird. Dabei unterstützen ihn ausgerechnet Zellen des angeborenen Immunsystems, die neutrophilen Granulozyten oder kurz Neutrophilen, die den Körper vor Krankheitserregern schützen sollen.
Normalerweise zirkulieren diese solange im Blut, bis sie –angelockt durch sogenannte Chemokine – in Gewebe einwandern, eingedrungene Krankheitserreger aufnehmen und sie unschädlich machen. Darüber hinaus sind sie in der Lage, die Bildung von Blutgefäßen auszulösen. Vermutlich helfen sie so, durch Entzündung zerstörtes Gewebe wieder aufzubauen. Neutrophile wandern jedoch auch in Krebsgewebe ein und tragen dort zum Anschluss an die Blutversorgung bei. Finden Ärzte viele Neutrophile im Tumor eines Patienten, leiten sie daraus eine ungünstige Prognose ab.
Bei einigen Tumoren wie Melanomen und Leukämien verordnen Ärzte IFN-β. Wissenschaftler des HZI in Braunschweig hatten schon vor einiger Zeit gezeigt, dass dieser Signalstoff das Krebswachstum behindern kann, indem er die Bildung neuer Blutgefäße hemmt. Wie er das tut, blieb allerdings zunächst ein Rätsel, denn lange Zeit war IFN-β vor allem für seine Wirkung gegen Viren bekannt.
Jetzt gelang es den Forschern, den Effekt von IFN-β auf molekularer Grundlage zu entschlüsseln. „Wir wollten verstehen, warum IFN-β die Neutrophilen daran hindert, in den Tumor einzuwandern“, sagt Dr. Jadwiga Jablonska-Koch, Wissenschaftlerin in der Abteilung „Molekulare Immunologie“ am HZI. „Nur so können Ärzte die bestehenden Therapien verbessern und die richtige Behandlung für den einzelnen Patienten auswählen.“
Dazu verfolgten die Wissenschaftler die Informationsübermittlung zwischen den Zellen. Ein häufig dafür genutztes Kommunikationsmittel sind Signalstoffe wie die Chemokine. Sie werden von Zellen produziert und binden an passend geformte Rezeptoren, also an Moleküle auf der Oberfläche derselben oder anderer Zellen. Im Fall der Neutrophilen handelt es sich um einen Rezeptor namens CXCR2. Er bindet die Chemokine CXCL1, CXCL2 und CXCL5. „Wir haben festgestellt, dass die Konzentration dieser Chemokine im Knochenmark, wo die Neutrophilen entstehen, niedrig ist“, sagt Dr. Siegfried Weiß, Leiter der Abteilung, in der Jablonska-Koch forscht. „Im Tumor dagegen finden wir eine hohe Konzentration, das lockt die Neutrophilen an.“ Dort angekommen, setzen die Immunzellen selber die gleichen Chemokine frei, um noch mehr Unterstützung herbeizurufen.
In diese Kommunikation funkt IFN-β hinein: Das Molekül sorgt dafür, dass die Zellen im Tumor weniger Chemokine herstellen. „So wandern weniger Neutrophile in das Krebsgewebe ein und weniger neue Blutgefäße werden gebildet“, sagt Jablonska-Koch. „Der Tumor wird nicht effizient an die für ihn lebensnotwendige Blutzufuhr angeschlossen und kann nur langsam weiter wachsen.“
Zellen von Krebspatienten produzieren verstärkt IFN-β. Oft ist es trotzdem therapeutisch sinnvoll, zusätzlich IFN-β zu geben. „Wir verstehen jetzt besser, warum IFN-β bei einigen Krebserkrankungen hilft und dass es ein wichtiger Teil des körpereigenen Systems zur Bekämpfung von Tumoren ist“, sagt Weiss. Ihre Erkenntnisse könnten Ärzten helfen, einzuschätzen, bei welchen Patienten die Gabe von IFN-β aussichtreich ist und wann die Neutrophilen ein Ziel der Krebstherapie sein sollten.