Erdbeere, Kirsche, Birke, Gras – verstärkt ein kleines Molekül allergische Reaktionen?
Eine Forschungsgruppe um Prof. Dr. Paul Rösch an der Universität Bayreuth ist bei der Untersuchung von Allergenen und ihren Wirkungen einen wichtigen Schritt vorangekommen. Erstmals ist es gelungen, das Hauptallergen der Birkenpollen in Verbindung mit seinem natürlichen Partnermolekül, dem Liganden, zu isolieren und diesen Liganden chemisch exakt zu bestimmen. Auch die biologische Funktion des Birkenpollenallergens konnte dabei aufgeklärt werden. Im Biochemical Journal haben die Wissenschaftler ihre Erkenntnisse veröffentlicht, die neue Möglichkeiten für die Erforschung von Allergien eröffnen.
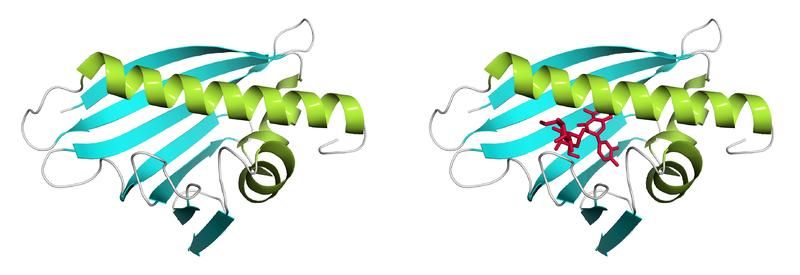
Bet v 1a, ein Hauptallergen der Birke. Die Funktion der großen Höhle (li.) als Bindungsstelle für einen Liganden (re.) wurde am Forschungszentrum für Bio-Makromoleküle der Uni Bayreuth aufgeklärt.
Forschungszentrum für Bio-Makromoleküle der Universität Bayreuth
In jedem Frühjahr, wenn der Wind die Pollen von Bäumen und Sträuchern in der Atemluft verbreitet, leiden viele Menschen unter Heuschnupfen und tränenden Augen, manche erleiden sogar einen lebensgefährlichen anaphylaktischen Schock. Es handelt sich um allergische Reaktionen, die durch bestimmte Proteine – sogenannte Allergene – ausgelöst werden. Diese Allergene finden sich insbesondere in den Pollen von Birken. Sie sind hinsichtlich ihrer molekularen Struktur denjenigen Allergenen ähnlich, die in Kirschen, Erdbeeren und anderen Früchten enthalten sind.
Charakteristisch für diese Gruppe von Allergenen ist eine strukturelle Besonderheit ihrer Moleküle: In ihrem Inneren befindet sich ein auffällige große Höhle. Deren Funktion war bis vor kurzem völlig unklar. Und auch die biologische Funktion, die diese Gruppe von Allergenen in den Pflanzen erfüllt, lag bisher im Dunkeln. Einer Arbeitsgruppe um Prof. Dr. Paul Rösch an der Universität Bayreuth ist es nun aber gelungen, beide Rätsel zu lösen – zumindest in Bezug auf das Hauptallergen der Birkenpollen. Es handelt sich hierbei um dasjenige Protein in den Birkenpollen, das im Vergleich mit anderen Birkenpollen-Proteinen besonders häufig allergische Reaktionen auslöst; seine chemische Bezeichnung lautet Bet v 1.
Erstmals identifiziert: der molekulare Partner des Birkenpollenallergens
Die Bayreuther Wissenschaftler haben dieses Allergen direkt aus den Pollen der Birken isolieren können; und zwar zusammen mit einem kleinen Partnermolekül, das in den Pollen an das Allergen bindet und daher als natürlicher Ligand bezeichnet wird. Die Funktion der Höhle im Inneren des Allergens besteht genau darin, dass der Ligand hier Platz findet und an das Allergen andockt. „Das von uns entwickelte Verfahren, um das Allergen in Verbindung mit seinem Liganden aus den Birkenpollen zu isolieren, erwies sich als komplex und zeitaufwändig“, berichtet Prof. Dr. Paul Rösch. „Es führte aber, im Unterschied zu dem bisher verfolgten Ansatz, zum Erfolg.“ Weltweit hatten Forscher zuvor mit gentechnisch hergestellten Allergenmolekülen gearbeitet und dabei vergeblich nach einem organischen Molekül gesucht, das in die Höhle des Allergens hineinpasst und hier gebunden wird.
Zusammen mit der Arbeitsgruppe von Prof. Dr. Wilfried Schwab an der TU München wurde der neu entdeckte Ligand untersucht und bestimmt. Es handelt sich um das organische Molekül Quercetin-3-O-sophorosid (Q3OS), das unter anderem für die Gelbfärbung der Pollen verantwortlich ist. Q3OS gehört der Stoffgruppe der Flavonol Glykoside an, die praktisch in allen Pflanzen vorkommen.
Neue Perspektiven für die Erforschung von Allergien
„Nachdem es uns gelungen ist, den natürlichen Liganden des Birkenpollenallergens zu identifizieren, eröffnen sich völlig neue Möglichkeiten der Allergenforschung. Bisher hat man vermutet, dass der Ligand eine zentrale Rolle bei der Entstehung von Allergien spielt. Als Partnermolekül des Allergens verstärkt es möglicherweise dessen Wirkung erheblich. Diese Hypothese lässt sich jetzt überprüfen – nicht nur für das Birkenpollenallergen, sondern auch für verwandte Allergene“, erklärt die Arbeitsgruppenleiterin Dr. Olivia Hartl-Spiegelhauer. Wie durch Lebensmittel- und Grasallergene, die dem Birkenpollenallergen strukturell sehr ähnlich sind, allergische Reaktionen ausgelöst werden, könne mit dem neuen Forschungsansatz weiter aufgeklärt werden.
Allergene sollen Pollen vor Sonnenlicht schützen
Bei der Entdeckung des Liganden ist die Bayreuther Forschergruppe auch der biologischen Funktion des Birkenpollenallergens auf die Spur gekommen. „Das Zusammenspiel zwischen dem Allergen und dem in seinem Inneren gebundenen Liganden schützt die DNA der Pollen vor Schädigungen durch UV-Strahlung. Birken geben ihren Pollen sozusagen einen Sunblocker mit auf die Reise durch den Frühling. Genau darunter müssen Allergiker dann aber leiden“, erklärt Dr. Olivia Hartl-Spiegelhauer, die an der Universität Bayreuth promoviert und hier auch das Elitestudienprogramm „Macromolecular Science“ erfolgreich abgeschlossen hat.
Bayreuther Beiträge zur Allergieforschung
Schon seit Beginn der 1990er Jahre sind einige der Moleküle bekannt, die als Allergene wirken. Die erste dreidimensionale Struktur des allergenen Proteins Bet v 1 konnte 1996 von einer dänischen Arbeitsgruppe aufgeklärt werden. Im Jahr 1999 gelang es dann der Bayreuther Arbeitsgruppe um Prof. Dr. Paul Rösch, die Struktur der Unterform Bet v 1a aufzuklären, die maßgeblich für allergische Reaktionen im menschlichen Körper verantwortlich ist. Es folgten dann an der Universität Bayreuth die dreidimensionalen Strukturen der eng mit dem Pollenallergen verwandten Lebensmittelallergene der Kirsche, des Soja und der Erdbeere. Diese allergenen Proteine sind, chemisch betrachtet, den Hauptallergenen des Apfels, des Selleries und der Karotte sehr ähnlich.
In dieser Ähnlichkeit von Proteinstrukturen liegt auch die Ursache von Kreuzallergien, wie die Bayreuther Arbeitsgruppe um Prof. Rösch schon vor mehreren Jahren zeigen konnte. Kreuzallergien sind Allergien des gleichen Patienten, die durch Allergene völlig verschiedenen Ursprungs ausgelöst werden. Wer beispielsweise gegen das Birkenpollenallergen Bet v 1 allergisch reagiert, ist sehr häufig auch Allergiker gegen das strukturell fast identische Lebensmittelallergen Pru av 1 der Kirsche. Neue Erkenntnisse zu den Strukturen der Allergene sind also nicht allein für die Grundlagenforschung von größter Bedeutung. Praktische Anwendungen können dazu beitragen, Allergene nachzuweisen oder zu vermeiden, aber auch Kreuzallergien vorherzusagen.
Originalveröffentlichung
Seutter von Loetzen C, Hoffmann T, Hartl MJ, Schweimer K, Schwab W, Rösch P, Hartl-Spiegelhauer O. The secret of the major birch pollen allergen Bet v 1 - identification of the physiological ligand. Biochem J. 2013 Oct 30. PMID: 24171862 [Epub ahead of print]
























































