Mit Hochdruck gegen Krebs-Gene: Neues Verfahren zeigt die Schwächen von Onkogenen
Onkogene („Krebs-Gene“) sind gefährlich. Die daraus resultierenden mutierten Proteine existieren dauerhaft in ihrer aktivierten Form und begünstigen unkontrolliertes Zellwachstum und damit die Bildung von Tumoren. Eine Behandlung scheitert häufig daran, dass Proteine in mehreren räumlichen Anordnungen bzw. Konformationen vorkommen. Der Zugriff mit entsprechenden Wirkstoffen wird so erschwert. Ein spezielles Verfahren bietet neue Möglichkeiten: Regensburger Forscher haben mit Hilfe der Hochdruck-Kernspinresonanzspektroskopie eine Methode entwickelt, mit der verschiedene Protein-Konformationen identifiziert und untersucht werden können. Für neue Therapien gegen Krebs gilt es jetzt, die „schwächeren“ Protein-Konformationen zu stabilisieren und direkt anzugehen.
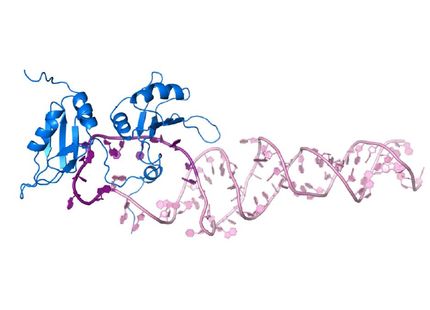
Im Rahmen ihrer Untersuchungen setzten die Forscher um Prof. Dr. Dr. Hans Robert Kalbitzer vom Institut für Biophysik und Physikalische Biochemie bei dem Protein Ras an, das als molekularer Schalter für die Ein- und Abschaltung zahlreicher Prozesse in den Zellen verantwortlich ist. Mutationen in Ras können allerdings dazu führen, dass der Schalter dauerhaft „angeschaltet“ bleibt und sich die Zellen unkontrolliert vermehren. Entsprechend finden sich in etwa 30 % aller menschlichen Tumoren Mutationen im Ras-Protein.
Wie alle anderen Proteine, die für die verschiedenen Prozesse der Signalübertragung in Zellen verantwortlich sind, existiert auch Ras in mehr als einer Konformation. Die einzelnen Konformationen eignen sich in unterschiedlicher Weise für eine sogenannte allosterische Hemmung, bei der die Wirkstoffe nicht an das aktive Zentrum des Proteins, sondern an eine andere Stelle – das allosterische Zentrum – anbinden.
Grundsätzliche thermodynamische Überlegungen lassen mindestens acht unterschiedliche funktionelle Konformationen des Ras-Proteins erwarten, die für eine allosterische Modulation oder auch Hemmung in Frage kommen. Dem Forscherteam gelang es bereits, vier davon durch die Kernspinresonanzspektroskopie unter Hochdruck-Bedingungen zu identifizieren.
„Doch damit ist das Potential der Hochdruck-Kernspinresonanzspektroskopie noch lange nicht ausgeschöpft. Mit der neuen Methode ist es prinzipiell möglich, auch für andere Proteine Strategien zur Hemmung von unerwünschten Protein-Protein-Interaktionen zu identifizieren“, erklärt Prof. Kalbitzer.
Die Ergebnisse der Regensburger Wissenschaftler sind vor kurzem in der Fachzeitschrift „Angewandte Chemie“ erschienen. Mögliche Anwendungsbereiche liegen mittel- bis langfristig in der Entwicklung neuartiger Therapien gegen unterschiedliche Krebsarten.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!