Wie Botox an Nervenzellen bindet
Forscher klären auf, wie Botulinum-Neurotoxin A an Protein-Rezeptor bindet und liefern damit eine Grundlage für neue Medikamente
Botulinum-Neurotoxin A, besser bekannt als Botox, ist ein hochgefährliches Gift, das beim Menschen Lähmungen verursacht und dadurch tödlich sein kann. In der Kosmetik wird die lähmende Wirkung kleiner Dosen gezielt zur zeitweiligen Beseitigung von Falten und in der Medizin etwa als Mittel gegen Migräne oder zur Korrektur von Strabismus (Schielen) eingesetzt. Einem Team von Forschern des Paul Scherrer Instituts, der Universität Utrecht und der Pharmafirma UCB ist nun ein wichtiger Schritt für das Verständnis der Wirkung des Botulinum-Neurotoxins A gelungen. Sie haben die Röntgenkristall-Struktur eines Protein-Komplexes bestimmt, die genau zeigt, wie das Toxinmolekül an den Proteinrezeptor, Synaptic Vesicle Protein 2, der Nervenzelle bindet, deren Aktivität vom Gift blockiert wird. Die Ergebnisse können nützlich sein für die Entwicklung verbesserter Botox-Medikamente, bei denen die Gefahr einer Überdosierung geringer ist als bisher. Die Struktur ist an der Synchrotron Lichtquelle Schweiz des Paul Scherrer Instituts bestimmt worden.
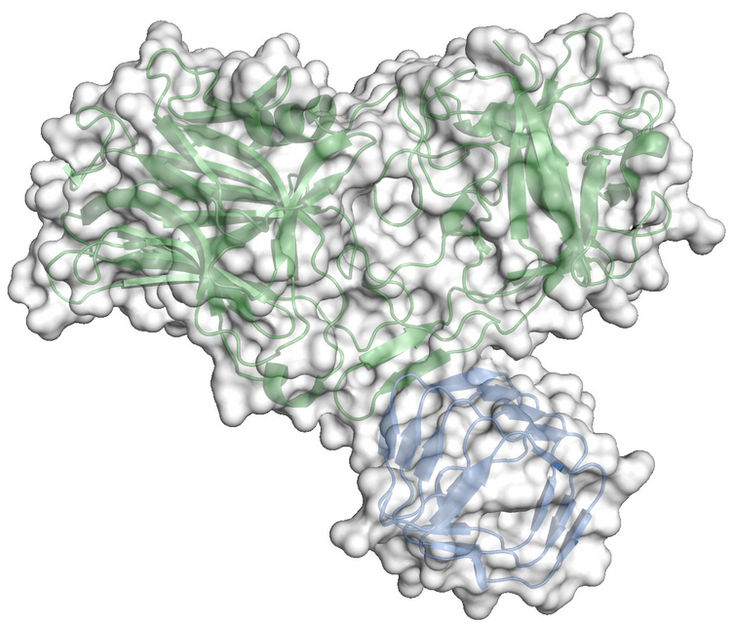
Die dargestellte Struktur zeigt, wie Botox and den Proteinrezeptor Synaptic Vesicle Protein 2 der Nervenzelle bindet. Zu sehen ist die Kristallstruktur des Komplexes bestehend aus der luminalen Domäne von Synaptic Vesicle Protein 2 (blau) und der Rezeptorbindungsdomäne von Botulinum-Neurotoxin A (grün).
PSI
Der Verzehr von verdorbenem Konservenfleisch kann bei Menschen zu Botulismus führen, einer Vergiftung, die lebensgefährliche Lähmungen verursacht. Schuld daran ist unter anderem das Gift Botulinum-Neurotoxin A, das vom Bakterium Clostridium botulinum erzeugt wird, das sich nur in der sauerstofffreien Atmosphäre in der Dose gut vermehren kann. Das Gift greift die Nervenzellen an und verhindert die Weiterleitung von Nervensignalen an die Muskeln. In den letzten Jahrzehnten wurden zunehmend praktische Anwendungen des Toxins entwickelt. Besonders bekannt ist die Verwendung in der Kosmetik, wo die Substanz unter dem Namen Botox verwendet wird. Unter die Haut gespritzt, führt das Toxin zu einer Entspannung der Muskeln und bringt so zeitweilig Falten zum Verschwinden. Das Mittel kommt aber auch häufig in der Medizin zum Einsatz, wo es etwa gegen Migräne angewandt wird. Bei Menschen, die unter Strabismus leiden, kann man mit Botulinum-Neurotoxin A gezielt einen Augenmuskel etwas schwächen und somit ein normales Sehen ermöglichen.
Synchrotronstrahlen enthüllen die Struktur des Protein-Komplexes
Ein grundlegender Schritt, der für die Entfaltung der Wirkung des Botulinum-Toxins notwendig ist, ist die Bindung von einem Molekül des Gifts an ein Molekül des Proteinrezeptors Synaptic Vesicle Protein 2 der Nervenzelle. Die Verbindung zwischen Rezeptor und Botulinum-Neurotoxin A-Molekül führt zu einer Kaskade von Schritten, durch welche die Nervenzelle gehindert wird, Botenstoffe auszuschütten, die normalerweise den Muskel zur Bewegung anregen. Einem internationalen Team unter der Leitung von Richard Kammerer am Labor für Biomolekulare Forschung des Paul Scherrer Instituts ist es nun gelungen, die genaue Struktur und somit die molekularen Wechselwirkungen zwischen Botox und dem Rezeptor zu bestimmen. Dazu haben die Wissenschaftler die beiden Moleküle, die an der Bindung beteiligt sind, im gebundenen Zustand untersucht, wobei sie vor allem verstehen wollten, wie genau die beiden Moleküle zusammenhalten. “Unsere Ergebnisse sind ein wichtiger Schritt, um die Wirkungsweise von Botulinum-Neurotoxin A besser verstehen zu können. Ich bin mir daher sicher, dass unsere Struktur grosse Resonanz im Feld erzeugen wird“ erklärt Kammerer. Zur Strukturbestimmung verwendeten die Forscher das Verfahren der Proteinkristallografie. Bei diesem Verfahren werden grosse Mengen Moleküle hergestellt und in einer regelmässigen Struktur – einem Kristall – angeordnet. Dieser Kristall wird dann mit Röntgenstrahlen aus der Synchrotron Lichtquelle Schweiz durchleuchtet. Die Grundlage dieser Technik besteht darin, dass Röntgenstrahlen durch die Moleküle im Kristall abgelenkt werden. Aus diesem sogenannten Beugungsmuster können die Forscher dann den atomaren Aufbau des untersuchten Moleküls bestimmen.
Neue Medikamente möglich
Die Ergebnisse tragen nicht nur zu unserem besseren Verständnis der Wirkung von Botox bei, sondern können möglicherweise auch von grossem praktischem Nutzen sein. „Botulinum-Neurotoxin A hat als Medikament ein sehr schmales therapeutisches Fenster“, erklärt Roger Benoit, Forscher am PSI und Erstautor des Artikels. „Das heisst, schon bei geringer Überdosierung kann es eine schädliche Wirkung haben. Mit unseren Ergebnissen sollte es möglich sein, Medikamente mit schwächerer Wirkung zu entwickeln, bei denen die Gefahr einer Überdosierung geringer wäre.“
























































