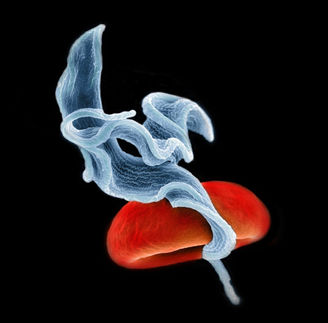
Das aktive Zentrum der Thiolase blockieren
Wissenschaftler der finnischen Universität Oulu und des HZB schaffen Grundlage für Erforschung neuer Medikamente gegen Schlafkrankheit
Wissenschaftler der finnischen Universität Oulu und des Helmholtz-Zentrum Berlin (HZB) haben neue Wege zur Medikamentenentwicklung gegen die afrikanische Schlafkrankheit und andere von Parasiten übertragene, tropische Erkrankungen aufgezeigt. Grundlage dafür sind Strukturuntersuchungen an einem als Thiolase bezeichneten Enzym. Thiolase spielt eine wichtige Rolle im Lipid-Stoffwechsel krankheitsübertragender Parasiten. Die Struktur des Biomoleküls haben die Forscher an der MX-Beamline des Elektronenspeicherrings BESSY II des HZB untersucht.
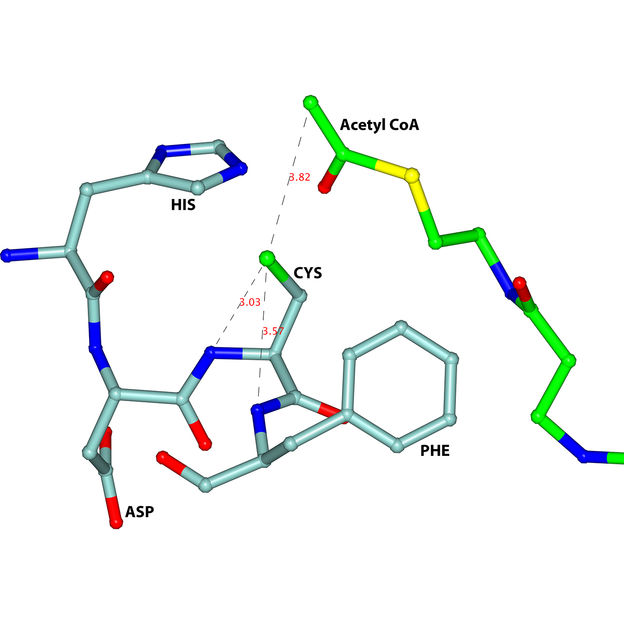
Ein Hauptmerkmal des aktiven Zentrums der trypanosomalen Thiolase ist der HDCF-Loop (HIS-ASP-CYS-PHE), dargestellt in hellem Blau.
University of Oulu
Die afrikanische Schlafkrankheit Trypanosomiasis oder die indische Leishmaniose sind tropische Krankheiten, die von Parasiten ausgelöst werden. An ihnen erkranken Jahr für Jahr erkranken Millionen von Menschen, tausende sterben daran. Medikamente gegen die Parasiten sind teuer und haben häufig starke Nebenwirkungen. Zudem sind seit Jahrzehnten keine neuen, wirksamen Therapeutika entwickelt worden. Die Weltgesundheitsorganisation WHO misst Forschungen zur Entwicklung entsprechender Wirkstoffe deshalb besondere Bedeutung zu.
Wissenschaftler um Prof. Rik Wierenga von der Universität Oulu haben dafür die Grundlage geschaffen und die Struktur des Enzyms Thiolase aufgeklärt. Thiolase ist für den Lipid-Stoffwechsel der Parasiten unverzichtbar. „Entscheidend ist der Aufbau des aktiven Zentrums des Enzyms“, sagt Wierenga: „Hier docken die für den parasitären Stoffwechsel wichtigen Lipide an. Und hier finden die chemischen Reaktionen statt, mit denen die Lipide umgebaut werden.“ Die Struktur und die Funktion des aktiven Zentrums gelte es zu erforschen, so Wierenga: „Dann kann man Substanzen entwickeln, die die Lipide imitieren, fest an das aktive Zentrum des Enzyms andocken und es damit blockieren.“ Die entsprechenden Moleküle sind hervorragende Ausgangspunkte für die Entwicklung neuer Pharmazeutika.
Die Untersuchungen der Thiolase am BESSY haben ein sehr detailliertes Bild vom aktiven Zentrum der Thiolase ergeben: „Zudem haben wir jetzt eine viel bessere Vorstellung von der Funktion der Thiolase“, sagt Wierenga: „Es sieht so aus, als ob sie den ersten Schritt im Stoffwechselweg der Sterol-Biosynthese katalysiert. Er hat bei mehreren Parasiten große Bedeutung.“
„Die Vermessung kristalliner Thiolase-Proteine an unserer MX-Beamline hat die Geometrie des aktiven Zentrums im Enzym aufgedeckt“, sagt Dr. Manfred Weiss vom HZB. Dabei hat eine spezifische Windung im Proteinmolekül eine besondere Bedeutung, der so genannte HDCF-Loop. Die Struktur, die sehr tief im Inneren der Thiolase liegt, war bisher unbekannt. „Die Kenntnis der HDCF-Struktur ist ein idealer Ausgangspunkt zur Entwicklung neuer Medikamente gegen die Parasiten“, fasst Rik Wierenga zusammen
Originalveröffentlichung
Harijan, R.K., Kiema, T.R., Karjalainen, et al., Crystal structures of SCP2-thiolases of Trypanosomatidae, human pathogens causing widespread tropical diseases: the importance for catalysis of the cysteine of the unique HDCF loop. Biochem J., 455, 119-130, 2013
Meistgelesene News
Originalveröffentlichung
Harijan, R.K., Kiema, T.R., Karjalainen, et al., Crystal structures of SCP2-thiolases of Trypanosomatidae, human pathogens causing widespread tropical diseases: the importance for catalysis of the cysteine of the unique HDCF loop. Biochem J., 455, 119-130, 2013
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.