Faszinierende Multitasking-Proteine
Kieler Biochemikerinnen und Biochemiker entschlüsseln Struktur und Funktion
Lysosomen sind kleine, eher unscheinbare Strukturen in unseren Zellen. Sie sind von einer Membran umgeben, die besetzt ist mit unterschiedlichen Proteinen. Die besondere Funktion eines dieser Proteine, LIMP-2, haben Wissenschaftlerinnen und Wissenschaftler vom Biochemischen Institut, Medizinische Fakultät, der Christian-Albrechts-Universität zu Kiel (CAU) zusammen mit Kolleginnen und Kollegen aus Bielefeld und Kanada, jetzt erstmals beschrieben.
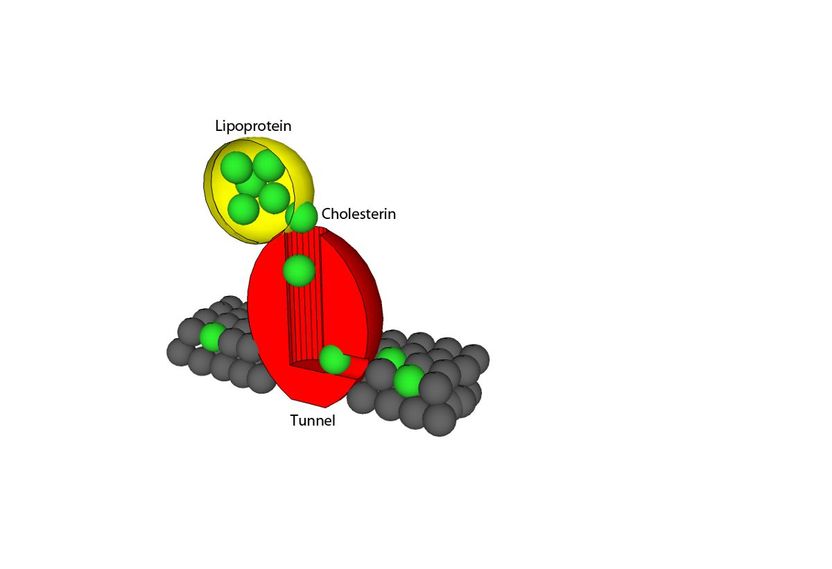
Das vereinfachte Modell zeigt, wie Membranproteine das Cholesterin an die Zellmembran transportieren.
J. Peters/CAU
Die Biochemikerinnen und Biochemiker konnten mit ihren Experimenten den genauen räumlichen Aufbau des Membranproteins LIMP-2 aufklären. Dieses Ergebnis half ihnen, auch die lang gesuchte Struktur zweier eng verwandter Proteine (SR-B1 und CD36) erstmals zu beschreiben. „Diese beiden Proteine sind wichtige Rezeptoren an unseren Zellmembranen und von entscheidender Bedeutung für krankmachende Prozesse wie Alzheimer, Demenz, Arterienverkalkung und bei Diabetes“, erklärt Professor Paul Saftig vom Biochemischen Institut der CAU. Man habe zwar geahnt, dass sie bestimmte Fette und insbesondere Cholesterin an die Zellmembranen weiterleiten müssen, wie diese Proteine das tatsächlich vermitteln können, habe man aber nicht gewusst, sagt der Biochemiker.
Die Auflösung der Struktur der Membranproteine ergab nun zwei überraschende Befunde. Zum einen formen diese Proteine einen Tunnel, durch den Cholesterin an die Membran transportiert werden kann. Blockieren Wissenschaftlerinnen und Wissenschaftler den Tunnel, so kann die Zelle kein Cholesterin aufnehmen. Zum anderen verstehen sie nun erstmals, wie diese Rezeptoren andere Proteine, zum Beispiel fettspaltende Enzyme oder mit Fett gefüllte Blutproteine (Lipoproteine), erkennen und binden können. „Faszinierend ist dabei, dass die Natur es geschafft hat, solche ‚Multitasking‘ Proteine zu entwickeln, die auf der einen Seite fetttragende Proteine binden und zum anderen die Fette dann unmittelbar durch ein Tunnelsystem an die richtige Stelle transportieren können“, erklärt Saftig.
An den mehrjährigen Experimenten waren neben Professor Paul Saftig auch Privatdozent Dr. Michael Schwake, jetzt Universität Bielefeld, sowie die Doktorandinnen Friederike Zunke und Judith Peters vom Biochemischen Institut der CAU beteiligt. Die grundlegenden neuen Erkenntnisse tragen zukünftig zur Entwicklung neuartiger Therapeutika, die zum Beispiel die Cholesterinaufnahme beeinflussen, bei.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.