Proteinteam stellt molekulare Fässer her
Forscher zeigen, dass zwei Proteinmaschinen bei der Ausbildung von Fassstrukturen in den Mitochondrien zusammenarbeiten
Die Arbeitsgruppen von Prof. Dr. Nikolaus Pfanner, Privatdozent Dr. Nils Wiedemann und Privatdozent Dr. Thomas Becker der Albert-Ludwigs-Universität Freiburg haben gemeinsam mit weiteren Kolleginnen und Kollegen nachgewiesen, wie molekulare Protein-Fässer in der äußeren Membran der Mitochondrien, den Kraftwerken der Zellen, entstehen. Dabei haben sie herausgefunden, dass zwei Proteinmaschinen auf unerwartete Weise kooperieren.
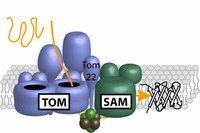
Die Proteinmaschinen TOM und SAM sind über Tom22 miteinander verbunden und arbeiten in der Reifung von Proteinen mit beta-Fassstruktur zusammen. Modifiziert nach Becker et al., 2008; Biochim. Biophys. Acta 1777, 447-563
© Thomas Becker (BBA-2008)
Mitochondrien sind für das Überleben der Zelle unerlässlich. Sie stellen zum Beispiel die Energie für den Zellstoffwechsel bereit. Mitochondrien sind von zwei Membranen umgeben. Die äußere Membran enthält charakteristische Proteine mit einem fassähnlichen Aufbau, der beta-Fassstruktur. Sie durchspannen die Membran und sind für den Transport von Proteinen und Stoffwechselprodukten in die Mitochondrien entscheidend. Die Proteine werden im Zytosol der Zelle als Vorstufen hergestellt und erhalten erst innerhalb des Mitochondriums ihre reife Fassstruktur. Dazu werden sie durch die Pore des Proteinkomplexes TOM, der Translokase der Außenmembran der Mitochondrien, importiert und zu einer zweiten Proteinmaschine der Außenmembran, der Sortierungs- und Assemblierungsmaschine SAM, transportiert. Der SAM-Komplex schließlich baut die Proteine in die Membran ein. Die einzelnen Schritte, die zur Ausbildung der beta-Fassstruktur führen, und der Transfer des Vorstufenproteins von TOM zu SAM waren bisher unverstanden.
Im Rahmen einer Kooperation zwischen dem Sonderforschungsbereich 746 „Funktionelle Spezifität durch Kopplung und Modifikation von Proteinen“, dem Exzellenzcluster BIOSS Center for Biological Signalling Studies und der Spemann Graduiertenschule für Biologie und Medizin analysierten die Forscher die Bildung der beta-Fassstruktur. Das Team um Nils Wiedemann zeigte, dass die beta-Fassstruktur am SAM-Komplex entsteht. Der Doktorand Jian Qiu entdeckte, dass das Rezeptorprotein Tom22 eine zentrale Rolle in diesem Prozess spielt. Dies ist überraschend, da man bisher davon ausging, dass TOM und SAM unabhängige Proteinmaschinen sind. Ergebnisse der Arbeitsgruppe von Thomas Becker zeigten aber, dass beide im direkten Kontakt miteinander stehen. Tom22 verbindet beide Komplexe, wie die Doktorandin Lena-Sophie Wenz herausfand. Fehlt Tom22, führt dies zum Verlust der molekularen Brücke zwischen TOM und SAM – was die Bildung von beta-Fassstrukturen erheblich beeinträchtigt. Die Ergebnisse dieser Studie zeigen, dass die direkte Übergabe des importierten Proteins vom TOM-Komplex zum SAM-Komplex eine effiziente Bildung mitochondrialer beta-Fassstrukturen erlaubt.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
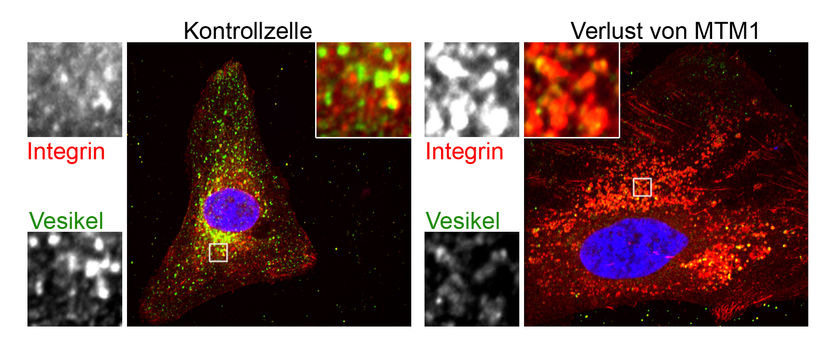
Wissenschaftler entschlüsseln Defekte in der seltenen Erbkrankheit Myotubuläre Myopathie

MoBiTec GmbH - Göttingen, Deutschland

opti-color Meß- und Regelanlagen GmbH - Bad Salzdetfurth, Deutschland





















































