Lecker Dimethylsulfid
So könnten Archaeen ihre Nahrung finden
Der Mikroorganismus Methanosarcina acetivorans lebt von allem, was er zu Methan verstoffwechseln kann. Wie er seine Energiequellen findet, ist bislang nicht klar. Wissenschaftler der Ruhr-Universität Bochum haben gemeinsam mit Kollegen aus Dresden, Frankfurt, Mülheim an der Ruhr und den USA ein Protein identifiziert, das ein „Nahrungssensor“ sein könnte. Sie charakterisierten das Molekül im Detail und fanden sowohl Gemeinsamkeiten als auch Unterschiede zu dem System, das bei Bakterien die Nahrungssuche übernimmt.
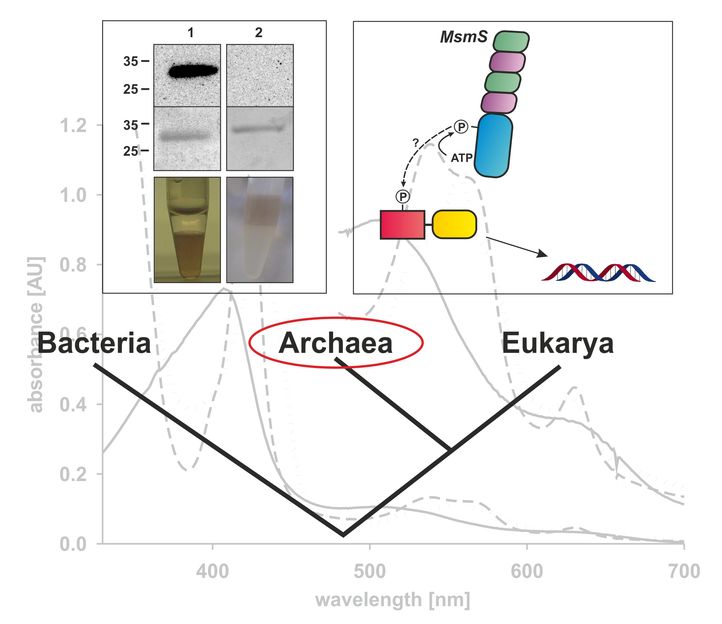
Der Stammbaum zeigt die Unterteilung aller Lebewesen in die drei Domänen des Lebens: Bacteria, Archaea und Eukarya (Organismen mit echtem Zellkern). Oben rechts: Das Protein MsmS aus dem Modellorganismus Methanosarcina acetivorans, einem methanogenen Archaeon, ist vermutlich an der Weiterleitung von Signalen innerhalb der Zelle beteiligt und verwendet dazu Phosphorylierungsmechanismen. Die Phosphatgruppe (P) für die Phosphorylierung stammt aus dem Energiespeichermolekül ATP. Oben links: MsmS bindet einen Häm-Cofaktor, welcher kovalent an das Protein gebunden vorliegt. Gezeigt sind zwei Methoden, mit denen die Forscher die kovalente Bindung nachwiesen, eine gelbasierte, spezifische Häm-Färbung sowie eine Zweiphasenextraktion mit dem organischen Lösungsmittel Butanon.
© Bastian Molitor
MsmS hat eine andere Funktion als gedacht
Das Protein MsmS war bislang nur bioinformatisch untersucht. Computeranalysen seiner Gensequenz hatten vorausgesagt, dass es sich dabei um ein Phytochrom, also um einen Rotlichtsensor handeln könnte. Mit spektroskopischen Methoden widerlegte das Forscherteam der aktuellen Studie diese Theorie. MsmS besitzt einen Häm-Cofaktor, wie auch Hämoglobin in roten Blutkörperchen, und kann unter anderem den Stoff Dimethylsulfid binden. Dabei handelt es sich um eine der Nahrungsquellen von Methanosarcina acetivorans. MsmS könnte dem Mikroorganismus also als Sensor dienen, um diese Energiequelle direkt oder indirekt aufzuspüren. In genetischen Untersuchungen fanden die Wissenschaftler außerdem Hinweise, dass MsmS Systeme aktiviert, die für die Verwertung von Dimethylsulfid wichtig sind.
Archaeen: flexible „Esser“
Methanosarcina acetivorans gehört zu den Archaeen, die neben Eukaryoten – also allen Lebewesen mit Zellkern – und Bakterien die dritte Domäne des Lebens bilden. Viele von ihnen sind an extreme Lebensbedingungen angepasst oder können ungewöhnliche Energiequellen nutzen. Unter den Organismen, die von der Methanproduktion leben, den sogenannten methanogenen Organismen, ist M. acetivorans eines der flexibelsten, was die Auswahl der Nahrungsquellen angeht. Viele verschiedene Moleküle setzt es zu Methan um, und gewinnt dabei Energie. Wie M. acetivorans wahrnimmt, ob Nahrung in der Nähe ist, ist bislang weitgehend unbekannt.
Bei Archaeen anders als bei Bakterien
Bakterien nutzen zu diesem Zweck das sogenannte Zwei-Komponenten-System: Kommt ein Sensorprotein mit der Nahrungsquelle in Kontakt, modifiziert sich das Protein selbst; es hängt eine Phosphatgruppe an einen bestimmten Aminosäurerest, das Histidin an. Die Phosphatgruppe wird anschließend auf ein zweites Protein übertragen. Das löst bei methanogenen Organismen zelluläre Prozesse aus, die die Methanproduktion in Gang bringen. Ähnlich wie in Bakterien könnten auch Archaeen vergleichbare Sensorproteine nutzen. MsmS wäre ein Kandidat für eine solche Aufgabe. Denn die Analysen des Forscherteams ergaben, dass es in der Lage ist, einen Phosphatrest auf eine Aminosäure zu übertragen. Ziel dieser Phosphorylierung ist aber wahrscheinlich nicht Histidin. „Es könnte also Unterschiede zwischen den Signaltransduktionssystemen von Archaeen und Bakterien geben“, spekuliert Prof. Dr. Nicole Frankenberg-Dinkel aus der AG Physiologie der Mikroorganismen. „Interessant ist auch, dass der Häm-Cofaktor kovalent, also über eine Elektronenpaarbindung, mit dem Protein verknüpft ist. Das ist ausgesprochen ungewöhnlich für Sensorproteine, die in der Zellflüssigkeit vorliegen.“























































