Evolution in der Antikörper-Fabrik
Wie Immunzellen ihre eigene Weiterentwicklung vorantreiben
Bei der Abwehr von Krankheitserregern spielen B-Zellen des Immunsystems eine entscheidende Rolle: Wenn sie einen solchen Eindringling entdecken, produzieren sie Antikörper, die bei seiner Bekämpfung helfen. Gleichzeitig verbessern sie diese Moleküle kontinuierlich, um die Erreger noch passgenauer zu erkennen. Ein Wissenschaftler-Team mit Beteiligung des Helmholtz-Zentrums für Infektionsforschung (HZI) fand heraus: Die Zellen beschleunigen dabei ihre eigene Evolution, indem sie den Selektionsdruck durch bereits produzierte Antikörper selbst erhöhen. Die Ergebnisse sind auch für neue Impfstrategien interessant.
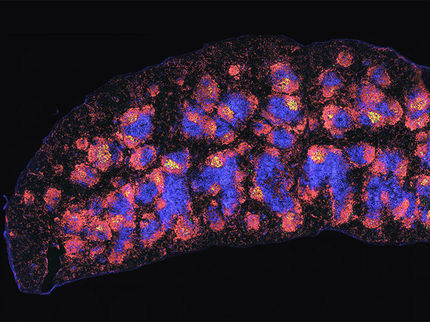
Farbenlehre für Immunologen: Ausgeklügelte Mikroskopie-Techniken erlauben den Forschern einen Einblick in die Evolution der Antikörper-Produzenten im Lymphknoten. Antikörper und Immunzellen sind mit unterschiedlichen Farben markiert.
© University of Birmingham/Toellner
Evolution bedeutet, um begrenzte Ressourcen zu konkurrieren und auf veränderliche Umweltbedingungen zu reagieren. Diesen Selektionsdruck machen sich die B-Zellen gewissermaßen selbst: Sie unterwerfen sich im Lymphknoten einem Optimierungs-Zyklus, den nur einige von ihnen überleben – diejenigen, die „bessere“ Antikörper-Moleküle bilden können als bereits im Körper vorhanden sind. Wie gut die Antikörper sind, wird im Lymphknoten getestet. Nur Zellen, die sich dabei bewähren, erhalten von anderen Immunzellen Signale, die ihr Überleben sicherstellen.
Jede B-Zelle trägt ein spezifisches Abwehrmolekül auf ihrer Oberfläche. Es erkennt bestimmte Strukturen von Krankheitserregern, so genannte Antigene – so wie ein Schlüssel in ein bestimmtes Schloss passt. Dieses Molekül wird außerdem in einer Variante produziert, die nicht auf der Zelloberfläche verbleibt, sondern mit Blut und Lymphe durch den Körper reist. Diesen Typus bezeichnet man als Antikörper. Trifft der Antikörper auf ein Antigen, bindet und neutralisiert er es oder alarmiert andere Mitspieler des Immunsystems.
Zu Beginn einer Infektion gibt es, bildlich gesprochen, mehrere Schlüssel, die aber noch nicht perfekt passen. Das ändert sich durch einen Prozess, den Immunologen als „somatische Hypermutation“ bezeichnen: Die B-Zellen mutieren diejenigen Gen-Abschnitte, die die Gestalt des Oberflächenmoleküls und damit später auch der löslichen Variante bestimmen – und so beeinflussen, wie stark die Antikörper an den Krankheitserreger binden. Die Zellen, bei denen die Passform des Schlüssels zunimmt, überleben und vermehren sich. Sie produzieren dann das gewünschte Molekül in großen Mengen und helfen uns so, schnell wieder gesund zu werden.
Doch woher wissen die Immunzellen, dass sie mit dem willkürlichen Mutieren auf dem richtigen Weg sind, dass der Schlüssel also danach besser passt? Diese Frage konnten Wissenschaftler aus England, Deutschland und der Schweiz in einem Kollaborationsprojekt zwischen Dr. Kai-Michael Toellner, Universität Birmingham, und Prof. Michael Meyer-Hermann, Leiter der Abteilung System-Immunologie am HZI, nun gemeinsam beantworten. Meyer-Hermann nutzt mathematische Modelle, um Krankheiten besser und schneller zu verstehen. „Die System-Immunologie ermöglicht es uns, in kurzer Zeit sehr viele experimentelle Bedingungen zu simulieren“, beschreibt er sein Spezialgebiet. Mithilfe solcher mathematischer Simulationen, gefolgt von experimentellen Überprüfungen, entdeckten die Forscher, dass die Antikörperproduzenten ihre eigene Evolution vorantreiben, was zweifellos eine Anpassung an den enormen Selektionsdruck darstellt, dem wir aufgrund einer ständigen Bedrohung durch Krankheitserreger ausgesetzt sind.
Schauplatz sind die so genannten Keimzentren in den Lymphknoten. Hier treffen die reifenden B-Zellen auf Antigene. Die Ergebnisse der Forscher deuten darauf hin, dass fertige Antikörper aus allen Keimzentren des Körpers wieder an den Orten der Antikörper-Produktion auftauchen und dort ebenfalls an Bruchstücke von Krankheitserregern binden. Dadurch stellen sie eine Konkurrenz für die Zellen dar, die noch dabei sind, die Passform ihrer Oberflächenmoleküle zu optimieren. Nur wenn die Immunzellen mit ihrem „Oberflächen-Schlüssel“ stärker an die „Antigen-Schlösser“ binden können als die fertigen Antikörper, erhalten sie Überlebenssignale und ihre Schlüsselform setzt sich durch.
„Das ist das bereits von Charles Darwin beschriebene ‚Überleben des Bestangepassten‘ auf molekularer Ebene“, vergleicht Meyer-Hermann. Untersuchungen in Mäusen konnten in Computersimulationen nur unter der Annahme bestätigt werden, dass die B-Zellen mit ihren eigenen Produkten, den Antikörpern, um die Bindung an Antigene konkurrieren.
Dieser erstaunliche Mechanismus könnte zukünftig auch gängige Impfmethoden verbessern. „Denkbar ist, Patienten zusätzlich zum Impfstoff auch mittelmäßig gut bindende Antikörper zu verabreichen“, erklärt Meyer-Hermann. „Unsere am Computer aufgestellten Modelle legen nahe, dass diese Methode den Prozess beschleunigt, optimale Antikörper zu identifizieren.“ Die Wissenschaftler vermuten, dass die Zugabe von Antikörpern die Impfreaktion manipuliert, da die neugebildeten Antikörper nun in Konkurrenz zu den von außen zugeführten Molekülen stehen. Die Selektionsbedingungen werden verschärft und die B-Zellen reagieren, in dem sie früher optimale Antikörper produzieren. Die Folge: Impfungen würden schneller wirken.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Antikörper
Antikörper sind spezialisierte Moleküle unseres Immunsystems, die gezielt Krankheitserreger oder körperfremde Substanzen erkennen und neutralisieren können. Die Antikörperforschung in Biotech und Pharma hat dieses natürliche Abwehrpotenzial erkannt und arbeitet intensiv daran, es therapeutisch nutzbar zu machen. Von monoklonalen Antikörpern, die gegen Krebs oder Autoimmunerkrankungen eingesetzt werden, bis hin zu Antikörper-Drug-Konjugaten, die Medikamente gezielt zu Krankheitszellen transportieren – die Möglichkeiten sind enorm.
Themenwelt Antikörper
Antikörper sind spezialisierte Moleküle unseres Immunsystems, die gezielt Krankheitserreger oder körperfremde Substanzen erkennen und neutralisieren können. Die Antikörperforschung in Biotech und Pharma hat dieses natürliche Abwehrpotenzial erkannt und arbeitet intensiv daran, es therapeutisch nutzbar zu machen. Von monoklonalen Antikörpern, die gegen Krebs oder Autoimmunerkrankungen eingesetzt werden, bis hin zu Antikörper-Drug-Konjugaten, die Medikamente gezielt zu Krankheitszellen transportieren – die Möglichkeiten sind enorm.