Herzmuskelzellen aus Vorläuferzellen hergestellt
Hoffnung für Herzinfarktpatienten
Durchbruch in der Herzstammzellforschung: Ein Forscherteam um Professor Katja Schenke-Layland vom Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB in Stuttgart hat erstmals Oberflächenmarker gefunden, mit denen sich lebende, funktionale kardiovaskuläre Vorläuferzellen der Maus identifizieren und isolieren lassen. Zugleich gelang es dem Team, dass sich diese kardiovaskulären Vorläuferzellen (CPCs) aus induziert-pluripotenten Stammzellen (iPS-Zellen) bilden. Aus diesen CPCs entwickelten sich alle im Herz vorkommenden Zellen. In der Maus integrierten sie sich in das Herz.
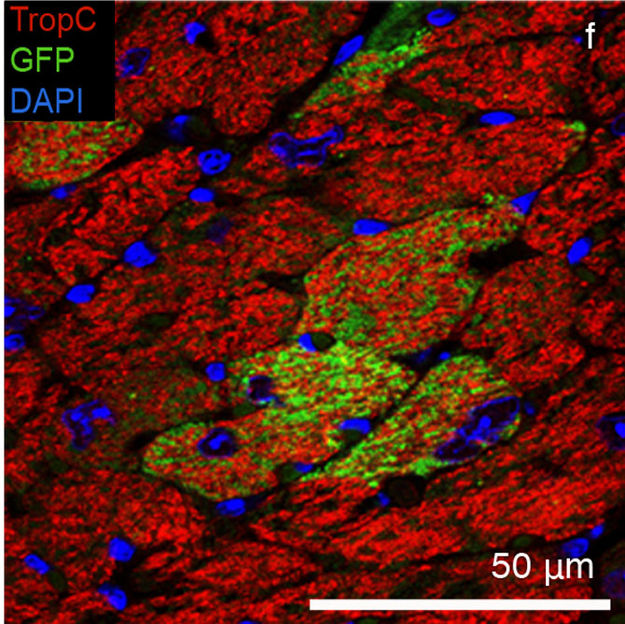
Werden die aus den GFP-iPS-Zellen entstandenen CPCs (grün) in das Herz einer lebenden Maus injiziert, verwandeln sie sich in funktionelles Herzmuskelgewebe (rot). Zellkerne sind blau.
Fraunhofer IGB
Bei einem Herzinfarkt stirbt – durch den Verschluss eines Herzkranzgefäßes, welches das Herz mit Blut versorgt – ein Teil des Herzmuskelgewebes ab. Die Herzmuskelzellen regenerieren sich im erwachsenen Menschen nicht, so dass bei einem großen Teil der Patienten die Pumpleistung des Herzens – und damit ein gutes Stück Lebensqualität – auf Dauer beeinträchtigt ist. Um die Funktionsfähigkeit des Herzens nach einem Herzinfarkt wiederherzustellen, bräuchten Mediziner funktionale adulte, das heißt reife und differenzierte Herzmuskelzellen, wie sie in einem erwachsenen Menschen vorkommen.
Die Differenzierung solch funktionaler Herzmuskelzellen aus klar definierten kardiovaskulären Vorläuferzellen (cardiovascular progenitor cells, CPCs) ist dem Forscherteam um Professor Dr. Katja Schenke-Layland vom Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB in Stuttgart und ihren Kollegen Dr. Ali Nsair von der University of California Los Angeles (UCLA) nun im Mausmodell gelungen. Die Arbeiten wurden jüngst in PLoS ONE veröffentlicht. Sie könnten die Therapie von Herzmuskelerkrankungen revolutionieren.
Entwicklung von Herzmuskelzellen aus Vorläuferzellen
Herzmuskelzellen entwickeln sich im Laufe der Embryonalentwicklung des Menschen und anderer Säuger – ebenso wie Endothelzellen und glatte Muskelzellen – aus den kardiovaskulären Vorläuferzellen. Diese sind daher seit langem für die medizinisch-biologische Forschung von großem Interesse, konnten bisher aber nicht wirklich genutzt werden. Der Grund: Die Marker, mit denen sich die kardiovaskulären Vorläuferzellen identifizieren lassen, wie beispielsweise Islet1 oder auch Nkx2.5, befinden sich im Inneren der Zellen. Der Nachweis der Vorläuferzellen geht also zwangsläufig mit ihrer Zerstörung einher. Damit die wertvollen Zellen auch für die Erforschung und Therapie von Herzmuskelerkrankungen zur Verfügung stehen, muss man sie »lebend« aus einer Kultur, in der verschiedene Zelltypen entstehen, herausfischen können.
Oberflächenmarker für kardiovaskuläre Vorläuferzellen identifiziert
An diese Aufgabe machte sich das Forscherteam um Professor Katja Schenke-Layland vom Fraunhofer IGB in Stuttgart und ihren Kollegen Dr. Ali Nsair von der UCLA in den USA, wo Schenke-Layland forschte, bevor sie mit dem Attract-Programm der Fraunhofer-Gesellschaft nach Deutschland zurückkehrte. Mit Erfolg: Sie konnten zwei Marker auf der Oberfläche der kardiovaskulären Vorläuferzellen nachweisen, mit denen sich diese Zellen eindeutig und unter vollem Erhalt ihrer biologischen Funktion identifizieren lassen, die Rezeptoren Flt1 (VEGFR1) und Flt4 (VEGFR3). Die kardiovaskulären Vorläuferzellen konnten die Wissenschaftler mit diesen Markern erstmals lebend markieren und isolieren.
»Für die Suche nach Oberflächenmarkern haben wir die kardiovaskulären Vorläuferzellen mit Hilfe von Genexpressionsanalysen auf Microarrays untersucht«, erläutert die Biologin Schenke-Layland ihre Vorgehensweise. »Diese Studien zeigen genau, welche Gene zu einem definierten Zeitpunkt aktiv sind.« Die aus dieser Analyse resultierenden Daten, jeweils ganz spezifische Abfolgen der vier Basen der DNA, haben die Forscher mit den Sequenzierungsdaten aus existierenden Datenbanken verglichen und auf solche durchsucht, die bereits als Oberflächenmarker bekannt waren.
Aus induziert-pluripotenten Stammzellen entwickeln sich kardiovaskuläre Vorläuferzellen
Doch damit nicht genug. Ermuntert durch den Erfolg, lebende CPCs identifizieren und isolieren zu können, haben die Forscher erstmals CPCs aus klinisch relevanten induziert-pluripotenten Stammzellen (iPS Zellen) »hergestellt«. Hierzu bedienten sie sich einer Methode, für die der japanische Wissenschaftler Shinya Yamanaka erst kürzlich mit dem Nobelpreis für Medizin 2012 ausgezeichnet wurde. Dieser publizierte vor sechs Jahren die revolutionären Ergebnisse, dass nur vier Proteine dafür verantwortlich sind, dass embryonale Stammzellen der Maus, aus frühen Embryonen gewonnen und in Zellkultur gezüchtet, ihre Pluripotenz behielten (Takahashi K., Yamanaka S. Cell 2006; 126(4): 663-676). Brachte er die vier Gene in differenzierte – reife und spezialisierte – Körperzellen ein, ließen sich diese in einen embryonalen Zustand zurückprogrammieren. Aus diesen Zellen, die er iPS-Zellen nannte, können sich wieder alle Körperzellen, beispielsweise Leberzellen, Nervenzellen oder auch Herzmuskelzellen entwickeln.
In ihrer Studie nahmen die Forscher um Schenke-Layland und Nsair, genau wie Yamanaka, Zellen eines Mausstamms. Allerdings solche, die mit einem unter dem Fluoreszenzmikroskop sichtbaren grün fluoreszierenden Protein (GFP) markiert sind. In diese Zellen schleusten sie – wie zuvor der Nobelpreisträger – die von ihm identifizierten vier Yamanaka-Gene über Retroviren als Transportvehikel ein. Tatsächlich ließen sich die reifen Mauszellen auf diese Weise in einen undifferenzierten Zustand zurückversetzen.
In einem nächsten Schritt züchteten die Forscher die GFP-markierten iPS-Zellen im Labor unter verschiedenen Bedingungen mit unterschiedlichen, das Zellwachstum beeinflussenden Faktoren, beispielsweise Wachstumsfaktoren. »Anhand unserer neu etablierten Nachweismethode mittels der Oberflächenmarker konnten wir in der Kultur Flt1- und Flt4-positive CPCs nachweisen und isolieren«, freut sich Schenke-Layland. »Wenn wir diese isolierten Maus-CPCs dann weiter in vitro kultivieren, entwickeln sie sich tatsächlich – wie auch die embryonalen Vorläuferzellen – zu Endothelzellen, glatten Muskelzellen und funktionalen, pulsierenden Herzmuskelzellen.«
Aus iPS-Zellen gewachsene CPCs integrieren sich in das lebende Mausherz
Doch wie verhalten sich die auf diese Weise entwickelten CPCs im lebenden Organismus? Können sich diese Zellen wirklich in das Herzgewebe integrieren und den Herzmuskel regenerieren? Um diese Fragen zu beantworten, injizierten die Wissenschaftler die GFP-markierten CPCs in das Herz einer lebenden Maus. Nach 28 Tagen analysierten die Forscher das Herz der Maus. »Die grün fluoreszierenden Zellen hatten sich zu schlagenden Herzmuskelzellen entwickelt und vollkommen in das Herzmuskelgewebe der Maus integriert«, sagt Schenke-Layland, die auch Stellvertretende Leiterin der Abteilung Zellsysteme am Fraunhofer IGB und Professorin für Biomaterialien in der kardiovaskulären regenerativen Medizin am Klinikum der Eberhard Karls Universität Tübingen ist.

























































