Neuer Mechanismus der DNA-Bindung identifiziert
Wissenschaftler aus Jena und München haben einen neuen Mechanismus der DNA-Bindung entdeckt. Teams um Axel Brakhage, Direktor des Leibniz-Instituts für Naturstoff-Forschung und Infektionsbiologie und Lehrstuhlinhaber an der Universität Jena und Michael Groll von der Technischen Universität München studierten die Wechselwirkung des in der Natur weit verbreiteten Proteinkomplexes CBC mit der DNA. Die spezifische Bindung von CBC an die DNA-Doppelhelix beeinflusst die Genaktivität und spielt damit eine wichtige Rolle in der Regulation von Lebensvorgängen in der Zelle wie auch bei der Entstehung von Krankheiten. Die Ergebnisse wurden in Structure veröffentlicht.
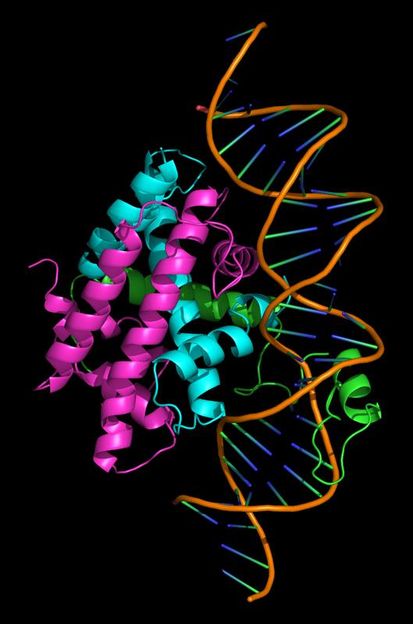
Der Proteinkomplex CBC bindet die DNA-Doppelhelix. Eine Untereinheit lagert sich in die kleine Furche und steuert so die Genaktivität.
TUM/Huber
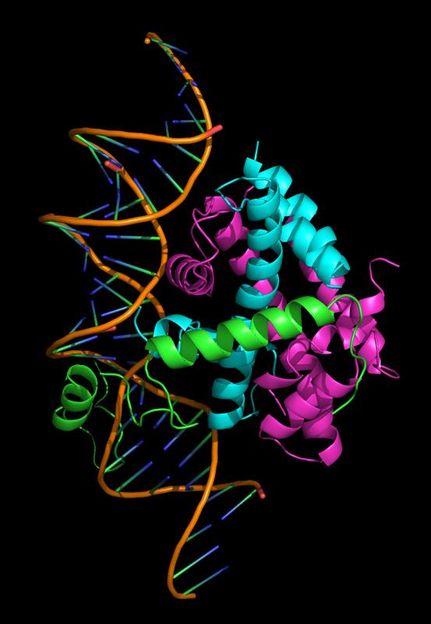
Der Proteinkomplex CBC bindet die DNA-Doppelhelix. Eine Untereinheit lagert sich in die kleine Furche und steuert so die Genaktivität.
TUM/Huber
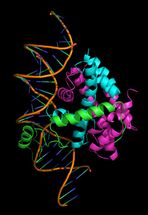
Den Teams um Axel Brakhage und Michael Groll ist es gelungen, einen neuartigen Mechanismus zu identifizieren, der eine Bindung an eine definierte DNA-Sequenz ermöglicht. Sie untersuchten am Schimmelpilz Aspergillus nidulans als Modellorganismus den Transkriptionsfaktor CBC. CBC steht für CCAAT Binding Complex, weil das Protein ein Komplex aus drei Untereinheiten ist, der auf der DNA exakt die Basensequenz CCAAT erkennt und daran bindet. Diese Bindung verändert die räumliche Struktur der DNA und ermöglicht somit das Ablesen der in der Nachbarschaft befindlichen Gene. Die genaue Wirkungsweise des CBC-Komplexes, der bei allen Organismen außer Bakterien vorkommt, war bislang unbekannt.
Die Forscher stellten durch gentechnische Methoden das CBC-Protein her und brachten es zur Kristallisation – mit und ohne gebundene DNA. Durch Röntgenkristallographie konnten die Münchener Kollegen zeigen, an welchen Stellen die Proteine den Kontakt mit der DNA eingehen. Die Wissenschaftler aus Jena führten detaillierte biochemische Analysen der Bindung durch und komplettierten so die Untersuchungen. Daraus ergibt sich nun erstmals ein genaues Bild des Bindungsmechanismus: zwei der CBC-Bestandteile biegen die DNA, während die dritte Untereinheit eine bestimmte Sequenz in der sogenannten kleinen Furche der DNA-Doppelhelix erkennt. Somit wird das Ablesen der Gene auf dem nachfolgenden DNA-Abschnitt ermöglicht. „Die Art und Weise, wie CBC an die DNA bindet, ist völlig neuartig und bietet uns interessante Einblicke in die evolutionäre Herkunft und Wirkungsweise dieses wichtigen Proteins“, erläutert Axel Brakhage die Ergebnisse. „Wir können diese Erkenntnisse nun verwenden um Krankheiten, an denen CBC beteiligt ist, besser zu verstehen. Möglicherweise kann CBC als Angriffspunkt für neue Medikamente dienen“.