Fertiges Herz schaltet Stammzellen aus
Transkriptionsfaktor Ajuba reguliert während der Embryonalentwicklung Stammzellaktivität im Herz
Neugeborene kommen nicht selten mit angeborenen Herzfehlern zur Welt. Grund dafür ist, dass die Entwicklung des Herzens im Embryo ein äußerst komplexer und zudem fehleranfälliger Vorgang ist. Wissenschaftler des Max-Planck-Instituts für Herz- und Lungenforschung in Bad Nauheim haben nun ein Schlüsselmolekül identifiziert, das die Funktion von Stammzellen im Herz entscheidend reguliert. Zukünftig könnten dadurch nicht nur angeborene Herzfehler vermieden werden, sondern es eröffnen sich auch neue Möglichkeiten, die Regeneration geschädigter Herzen bei Erwachsenen zu stimulieren.
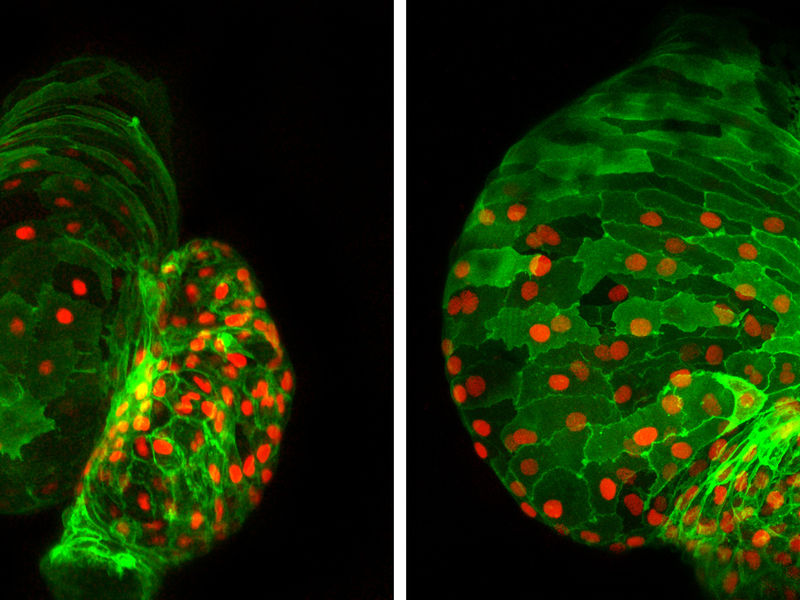
Herzentwicklung außer Kontrolle: Fehlt der Transkriptionsfaktor Ajuba während der Herzentwicklung, wie dies im rechten Foto aufgrund eines genetischen Eingriffs ist, wird die Entwicklung des Herzens im Fischembryo gestört. Neben einer erhöhten Anzahl an Herzmuskelzellen (grün mit rot gefärbten Zellkernen) wird das Herz während der Entwicklung zusätzlich deformiert.
© MPI f. Herz- und Lungenforschung
Vom Zellhaufen bis zum fertigen Herzen ist es ein weiter Weg. Durch Zellteilung wird aus der Ansammlung von zunächst nur wenigen Herz-Stammzellen ein immer größer werdendes Gebilde. Daraus entwickeln sich die verschiedenen Strukturen des Herzens, wie Herzkammern, Vorhöfe, Herzklappen und Kranzgefäße. Dabei unterlaufen die Stamm- und Vorläuferzellen einem komplexen Prozess. Neben einer eng regulierten Zellteilungsaktivität gehören auch die Wanderung der Zellen sowie ihre Differenzierung und Spezialisierung. Mit der Fertigstellung des Herzens werden die Stammzellen schließlich abgeschaltet.
Wissenschaftler vom Max-Planck-Institut für Herz- und Lungenforschung in Bad Nauheim haben nun herausgefunden, wie wesentliche Teile dieses Entwicklungsprozesses reguliert werden. Dazu suchten sie zunächst gezielt nach Bindungspartnern für den Transkriptionsfaktor Isl1. Isl1 ist charakteristisch für eine bestimmte Gruppe von Herzstammzellen, die deshalb auch als Isl1+-Zellen bezeichnet werden. Durch ihre Suche kamen die Forscher Ajuba auf die Spur, einem Transkriptionsfaktor aus der Gruppe der LIM-Proteine. „Wir haben daraufhin die Interaktion beider Moleküle genauer untersucht und kamen zu dem Ergebnis, dass es sich bei Ajuba um einen wichtigen Schalter handeln muss“, sagt Gergana Dobreva, Leiterin der Forschungsgruppe „Ursprung kardialer Linien“ am Bad Nauheimer Max-Planck-Institut.
Daraufhin untersuchten die Wissenschaftler im Tiermodell, welche Auswirkungen ein defekter Schalter auf die Herzentwicklung hat. Besonders eindrucksvoll lässt sich die Embryonalentwicklung im Zebrabärbling untersuchen. Die Bad Nauheimer Forscher erzeugten deshalb durch einen genetischen Eingriff Fische, denen ein funktionierendes Ajuba fehlte. Tatsächlich kam es bei diesen Tieren zu einer starken Störung der Herzentwicklung. Neben einer Deformation des Herzens, verursacht durch eine Verdrehung der Herzachse, fiel den Forschern im Vergleich zu Kontrolltieren vor allem ein Größenunterschied auf. „Bei fast allen untersuchten Fischen stellten wir eine drastische Vergrößerung des Herzens fest. Fehlt Ajuba, gibt es offensichtlich keinen anderen Schalter, der am Ende den von Isl1 gesteuerten Teil der Herzentwicklung ausschaltet“, so Dobreva.
Weitere Analysen ergaben, dass die Vergrößerung des Herzens tatsächlich auf eine stark erhöhte Anzahl an Herzmuskelzellen zurückzuführen ist. Die Ursache dafür wiederum war, dass bereits ab einer frühen Phase der Entwicklung die Anzahl der Isl1+-Zellen, also der Vorläuferzellen der Herzmuskelzellen, deutlich erhöht war. Für die Kontrolle der Stammzellaktivität wiederum ist Ajuba entscheidend: Es bindet an Isl1-Moleküle und blockiert auf diese Weise deren stimulierenden Effekt.
Aus den Ergebnissen der Studie könnten sich zukünftig neue Anwendungsmöglichkeiten ergeben. „Wenn wir die Regulation der Herzentwicklung verstehen, lernen wir auch die Ursachen für die Bildung von angeborenen Herzfehlern kennen und können so über Ansätze für Therapien nachdenken“, so Dobreva. Darüber hinaus lassen sich auf diese Weise auch geschädigte Herzen von Erwachsenen reparieren: „Eine Möglichkeit wäre, im Labor die Gewinnung von Ersatzzellen aus embryonalen oder künstlich erzeugten Stammzellen zu optimieren. Durch das Ausschalten von Ajuba in diesen Zellen dürfte sich deren Entwicklung hin zu funktionellen Herzmuskelzellen verstärken lassen. Man könnte so ausreichend viele Ersatzzellen zur Behandlung von Patienten züchten.“ Eine weitere Möglichkeit ist zudem, durch das Ausschalten von Ajuba im geschädigten Herz die Stammzellaktivität und damit die Regeneration des Herzens selbst zu stimulieren. Inwieweit dies möglich ist, soll nun in weiteren Studien untersucht werden.
Originalveröffentlichung
Hagen R. Witzel, Benno Jungblut, Chong Pyo Choe, J. Gage Crump, Thomas Braun, and Gergana Dobreva; The LIM Protein Ajuba Restricts the Second Heart Field Progenitor Pool by Regulating Isl1 Activity. Developmental Cell (2012)





















































