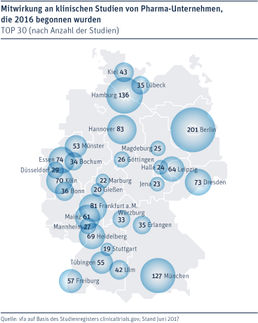
Actelions Macitentan erreicht primären Endpunkt in zulassungsrelevanter Phase-III-Studie SERAPHIN
Actelion teilte mit, dass aufgrund der ersten Datenanalyse die zulassungsrelevante, auf klinische Ereignisse ausgerichtete Langzeitstudie SERAPHIN mit dem neuartigen dualen Endothelin-Rezeptor-Antagonisten Macitentan, bei der 742 Patienten mit pulmonaler arterieller Hypertonie (PAH) bis zu dreieinhalb Jahre lang behandelt worden waren, ihren primären Endpunkt erreicht hat.
Mit Macitentan konnte bei beiden verwendeten Dosierungen (3mg und 10mg) im Verlauf der Behandlungsdauer das Risiko eines Morbiditäts- oder Mortalitätsereignisses gegenüber Plazebo gesenkt werden. Dieses Risiko konnte in der Gruppe, die mit einer Dosis von 10 mg behandelt wurde, um 45 Prozent (p<0,0001) gesenkt werden. Bei 3 mg wurde eine Risikoverminderung von 30 Prozent (p=0,0108) beobachtet. Die Behandlung mit Macitentan wurde in der SERAPHIN-Studie gut vertragen.
Auch für die sekundären Endpunkte konnte eine dosisabhängige Wirkung aufgezeigt werden (p<0,05 für jede Dosis). Hierzu zählen die Veränderung nach 6 Monaten im Vergleich zum Ausgangswert beim Sechs-Minuten-Gehtest, die Veränderung der WHO-Funktionsklasse nach sechs Monaten im Vergleich zum Ausgangswert und die Zeit bis zum Eintritt des Todes infolge von PAH oder einer Hospitalisierung im Zusammenhang mit PAH über die gesamte Behandlungsdauer. Hinsichtlich der Gesamtmortalität wurde ein Trend zugunsten der Dosis von 10 mg Macitentan beobachtet (p=ns).
Meistgelesene News
Organisationen
Weitere News aus dem Ressort Forschung & Entwicklung

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.