Stoffwechselkrankheiten und Antibiotikaresistenz auf der Spur
Proteine, die zur wichtigen und großen Familie der ABC-Transporter gehören, können Stoffwechselkrankheiten und Antibiotikaresistenzen verursachen. Biochemikern der Universität Zürich und des NCCR Strukturbiologie ist es gelungen, die atomare Struktur eines neuen Transporters aufzuklären. Die gewonnenen Einsichten könnten zu neuen Therapien führen, beispielsweise gegen multiresistente Bakterien, zystische Fibrose oder Gicht.
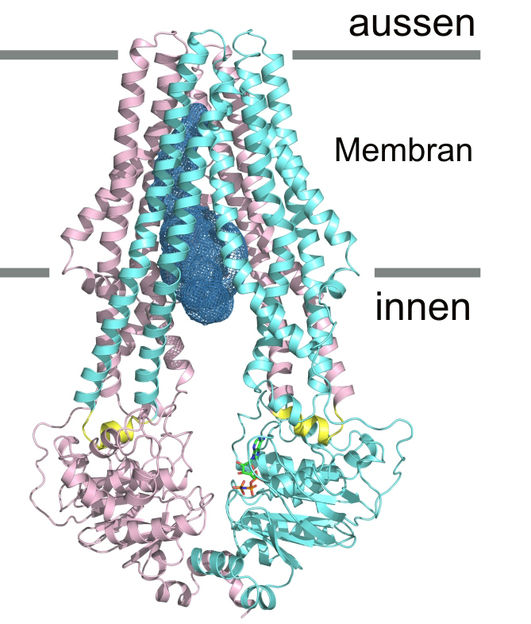
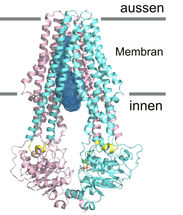
Detailansicht von «TM287/288»: Der Transporter ist nach innen geöffnet. Die beiden unterschiedlichen Proteinketten sind in türkis und pink eingefärbt.
UZH
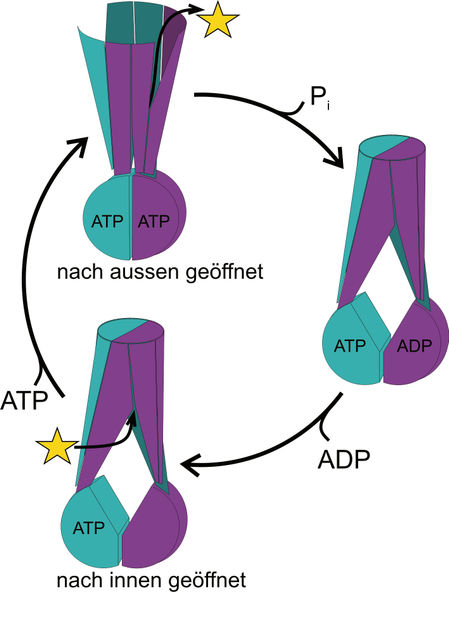
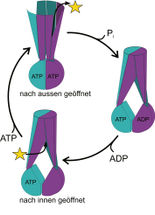
Transportmechanismus: Der nach innen geöffnete Transporter kann ein Molekül, z.B. ein Antibiotikum (gelber Stern) binden. Unter Energieverbrauch öffnet er sich nach aussen und entlässt das zuvor gebundene Antibiotikum.
UZH
ABC-Transporter sind Membranproteine, die aktiv eine Vielzahl an Molekülen durch die Membran pumpen. Mehr als 40 verschiedene ABC-Transporter erfüllen beim Menschen lebensnotwendige Funktionen. Genetische Defekte in ABC-Transportern können zu Stoffwechselkrankheiten führen, wie beispielsweise Gicht, neonatalem Diabetes oder zystischer Fibrose. Gewisse ABC-Transporter verursachen zudem Resistenzen gegen ein breites Spektrum an Medikamenten. In Tumorzellen werden oft erhöhte Mengen an ABC-Transportern produziert, die Chemotherapeutika aus der Krebszelle herauspumpen. Krebsmedikamente verlieren dadurch ihre Wirkung. Analoge Mechanismen spielen bei vielen pathogenen Bakterien eine entscheidende Rolle: ABC-Transporter befördern Antibiotika aus der Zelle – multiresistente Bakterien sind die Folge.
Trotz ihrer großen Bedeutung in Biologie und Medizin ist bis anhin nur von wenigen ABC-Transporten die atomare Struktur entschlüsselt. Nun ist es dem Doktoranden Michael Hohl und dem wissenschaftlichen Mitarbeiter Christophe Briand unter der Leitung von Markus Seeger und Prof. Markus Grütter gelungen, die atomare Struktur des neuartigen ABC-Transporters «TM287/288» aufzulösen.
Aufschlussreiche Asymmetrie
Das Membranprotein stammt ursprünglich aus einem wärmeliebenden Bakterium. Im Vergleich zu bereits bekannten Strukturen besitzt «TM287/288» zwei unterschiedliche Proteinketten, die sich zu einem Heterodimer formieren. Etwa die Hälfte der 40 menschlichen ABC-Transporter sind Heterodimere. «Die entdeckten Asymmetrien erlauben es uns, die Funktion von ABC-Transportern neu zu betrachten», erklärt Markus Seeger. «Unsere Resultate könnten längerfristig dazu beitragen, neue Medikamente gegen multiresistente Bakterien oder schwierig zu behandelnde Tumore zu entwickeln. Sie ermöglichen auch neue Ansätze zur Heilung oder Linderung von Erbkrankheiten», schließt Markus Grütter.