Neuer Forschungsansatz gibt Menschen mit Muskelschwund Hoffnung
Einem Forschungsteam der Neurologischen Klinik und des Departements Biomedizin der Universität Basel ist es kürzlich gelungen, eine bestimmte Form von erblich bedingtem Muskelschwund auf molekularer Ebene zu erklären. Die Wissenschaftler unter der Leitung des Neurologen Michael Sinnreich haben gezeigt, dass das körpereigene Qualitätssicherungssystem bei der Entstehung von Muskelschwund eine fatale Rolle ausüben kann. Seine gezielte Ausschaltung erlaubt einem durch Mutationen veränderten Reparaturprotein seine Funktion wieder zu erlangen und dadurch Schädigungen von Muskelzellmembranen zu beheben.
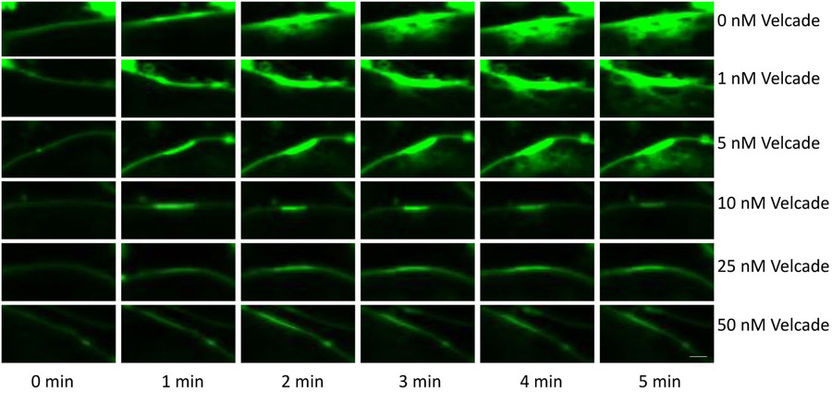
Der Wirkstoff Bortezomib führt mit steigender Dosierung zur Reparatur von Zellmembranen der Muskelzellen von Patienten mit Muskeldystrophie. Mehr aufgenommener Fluoreszenzfarbstoff bedeutet weniger Reparatur.
Universität Basel
Muskeldystrophie oder Muskelschwund zeichnet sich durch den krankheitsbedingten Abbau von Skelettmuskelzellen aus. Menschen, die an einer solchen vererbbaren Krankheit leiden, sind in ihrem Leben stark beeinträchtigt. Eine bestimmte Form von Muskelschwund wird durch Mutationen des Membranproteins Dysferlin verursacht. Dysferlin ist ein Reparaturprotein, das bei Verletzungen der Muskelzellmembran in Funktion tritt. Mutiertes Dysferlin wird von der körpereigenen Qualitätskontrollstelle, dem Proteasom, als defekt erkannt und in der Folge rasch eliminiert. Ohne Dysferlin können jedoch verletzte Muskelmembranen nicht oder nur ungenügend repariert werden. Dies führt zu den beobachteten Symptomen von Muskelschwund.
Der Forschungsgruppe «Neuromuscular Research» von Prof. Michael Sinnreich am Departement Biomedizin der Universität Basel ist es kürzlich gelungen, die Funktionstüchtigkeit von mutierten Dysferlin-Proteinen wieder herzustellen. Mit den Proteasom-Inhibitoren Lactacystin und Bortezomib liess sich mutiertes Dysferlin in kultivierten menschlichen Muskelzellen von Patienten mit Muskelschwund reaktivieren. Offenbar neutralisiert die körpereigene Qualitätskontrollstelle mutiertes Dysferlin selbst dann, wenn die Reparaturfähigkeit von mutierten Dysferlin unverändert (oder nur minimal beinträchtig) ist.
Diese grundlegenden Erkenntnisse könnten in neuartige Behandlungsmöglichkeiten für bestimmte Muskeldystrophien einfließen. Eine klinische Studie mit dem für andere Indikationen zugelassenen Medikament Velcade® (Wirkstoff Bortezomib) wird gegenwärtig am Neuromuskulären Zentrum, Klinik für Neurologie, des Universitätsspitals Basel durchgeführt. Diesem Forschungsprojekt wurde kürzlich ein «Rare Diseases – New Approaches»-Grant der Gebert Rüf Stiftung zugesprochen.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Bilal A. Azakir, Sabrina Di Fulvio, Jochen Kinter and Michael Sinnreich; Proteasomal inhibition restores biological function of mis-sense mutated dysferlin in patient derived muscle cells; Journal of Biological Chemistry. First Published on February 8, 2012
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.